1.3. Méningite post-neurochirurgicale
François PROUST, M.D., Ph.D., CHRU Strasbourg, décembre 2021
Questions
Quelle est approximativement la prévalence globale de la méningite post-neurochirurgicale ? :
- 10%
- 8-16%
- 0.1-0.5 %
- 0.3-8.6%
- 2%
Quelle est la prévalence de la MPN lors de dérivation ventriculaire externe ?
- 1%
- 8%
- 25%
- 14%
- 0.8%
Quels sont les germes ciblés par l’antibioprophylaxie ?
- Bactéries gram +
- BNG
- Pseudomonas
- Staphylococcus aureus
- Pyocianique
La durée d’incubation du milieu de culture doit être au minimum de :
- 5 jours
- 15 jours
- 10 jours
- 48 heures
- 60 jours
Quelles sont les stratégies thérapeutiques adaptées ?
- Une antibioprophylaxie préopératoire de Vancomycine
- Une antibiothérapie probabiliste composée de Vancomycine associée à une céphalosporine antipseudomonas.
- Une Ablation du système de drainage du LCS
- Une thérapie intrathécale systématiquement associée
- Le réimplantation du matériel de drainage à J5.
Memento didactique
Introduction
La méningite bactérienne aigue est la plus commune des infections purulentes du système nerveux central, et, constitue une urgence médicale (1). L’objet de notre propos est la méningite survenant dans une atmosphère neurochirurgicale ou méningite post-neurochirurgicale (MPN) à distinguer de la méningite bactérienne d’acquisition communautaire. Ces méningites nosocomiales, secondaires à une craniotomie ou un système de dérivation du liquide cérébro-spinal (LCS), sont caractérisée par des germes difficiles à identifier dans un contexte d’immunodépression de l’hôte (2, 3).
La MPN est une infection nosocomiale grave en raison des conséquences neurologiques, du taux de mortalité, et du coût économique. Son taux d’incidence varie entre 0.3% et 8.6%, selon différents facteurs comme un désordre du LCS, une infection systémique concomitante, la durée de l’acte chirurgical (4, 5).
Épidémiologie et pathogénie
Craniotomie
La prévalence est estimée entre 0.8 et 1.5% (4, 6). Approximativement, 1/3 surviennent durant la première semaine. Plusieurs points de technique neurochirurgicale peuvent minimiser la survenue de MPN. Ils sont récapitulés dans le tableau 1.
Tableau 1. Principes de techniques neurochirurgicales pour minimiser le risque de méningite nosocomiale (The New England journal of medicine. 2010 ;362(2):146-54).
Préopératoire
• Douche pré-opératoire
• Détersion-shampoing cheveux et scalp à l’aide d’une solution moussante antiseptique puis rinçage à l’eau. Tonte mais pas de rasage.
• Application large d’un antiseptique alcoolique sur le champ opératoire.
• Drapage du champ opératoire avec champs adhésifs transparents.
• Règles rigoureuses d’asepsie pour maintenir stérile le champ opératoire.
• Antibioprophylaxie avant incision afin d’obtenir une concentration tissulaire optimale : céfazoline, 2gr IV, 15’ avant l’incision à renouveler 1x si durée supérieure à 4 heures.
Durant la chirurgie
• Minimiser l’hypothermie et pertes sanguines,
• Double paire de gants pour implantation de matériel,
• Irrigation du champ opératoire avec solution physiologique,
• Hémostase et circulation du LCS sans mise en tension des tissus,
• Fermeture soigneuse des différents plans.
Postopératoire
• Éviter les drains et si usage, tunnelisation longue,
• Pansement occlusif temporaire, shampooing bétadiné quotidien,
• Prévention des contraintes mécaniques.
Dérivation interne du LCS
Lors de dérivation ventriculaire interne, la prévalence est estimée entre 4 et 17% (3). La MPN serait favorisée par perforation de gants et manipulation directe du cathéter avant implantation.
Dérivation externe du LCS
De prévalence 8%, la MPN n’augmente pas avec la durée du drainage ventriculaire externe. Les facteurs de risque étaient les manipulations du drain, les fuites de LCS, l’hémorragie intraventriculaire (3).
En lombaire, cette dérivation externe se complique d’infection chez 0.8 % des patients.
Microbiologie
Les bactéries de la flore cutanée telles que staphylocoque coagulase négative, le staphylococcus aureus ou le propionibacterium acnés sont prédominantes. Cependant, les bacilles gram – sont impliqués dans 18% à 56% des MPN (2). L’antibioprophylaxie actuelle recommandée en neurochirurgie, comme les antibiotiques des cathéters imprégnés (minocycline, clindamycine), ciblent essentiellement les bactéries gram +. Ces stratégies en réduisent l’incidence (7). Ainsi, le spectre des bacilles gram - devient prédominant renforcé par l’émergence de bactéries gram – multirésistantes tels que l’acinetobacter baumannii (8).
Diagnostic de méningite post neurochirurgicale (MPN)
Une clinique peu évocatrice
A l’inverse de la méningite communautaire, de multiples causes de confusion sont responsables de la difficulté diagnostique. Les germes couramment en cause, staphylocoque coagulase négative et propionibacterium acnes, déterminent des formes de fièvre modérée associée à une sensation de malaise. La fièvre neurogénique est commune, et, de multiples sources d’infections post-opératoires sont possibles. Le syndrome méningé post-opératoire de nature inflammatoire commun lié soit à la contamination sous-arachnoïdienne sanguine ou à une méningite aspetique, concerne moins de 50% des patients (3).
Une biologie du LCS d’interprétation difficile
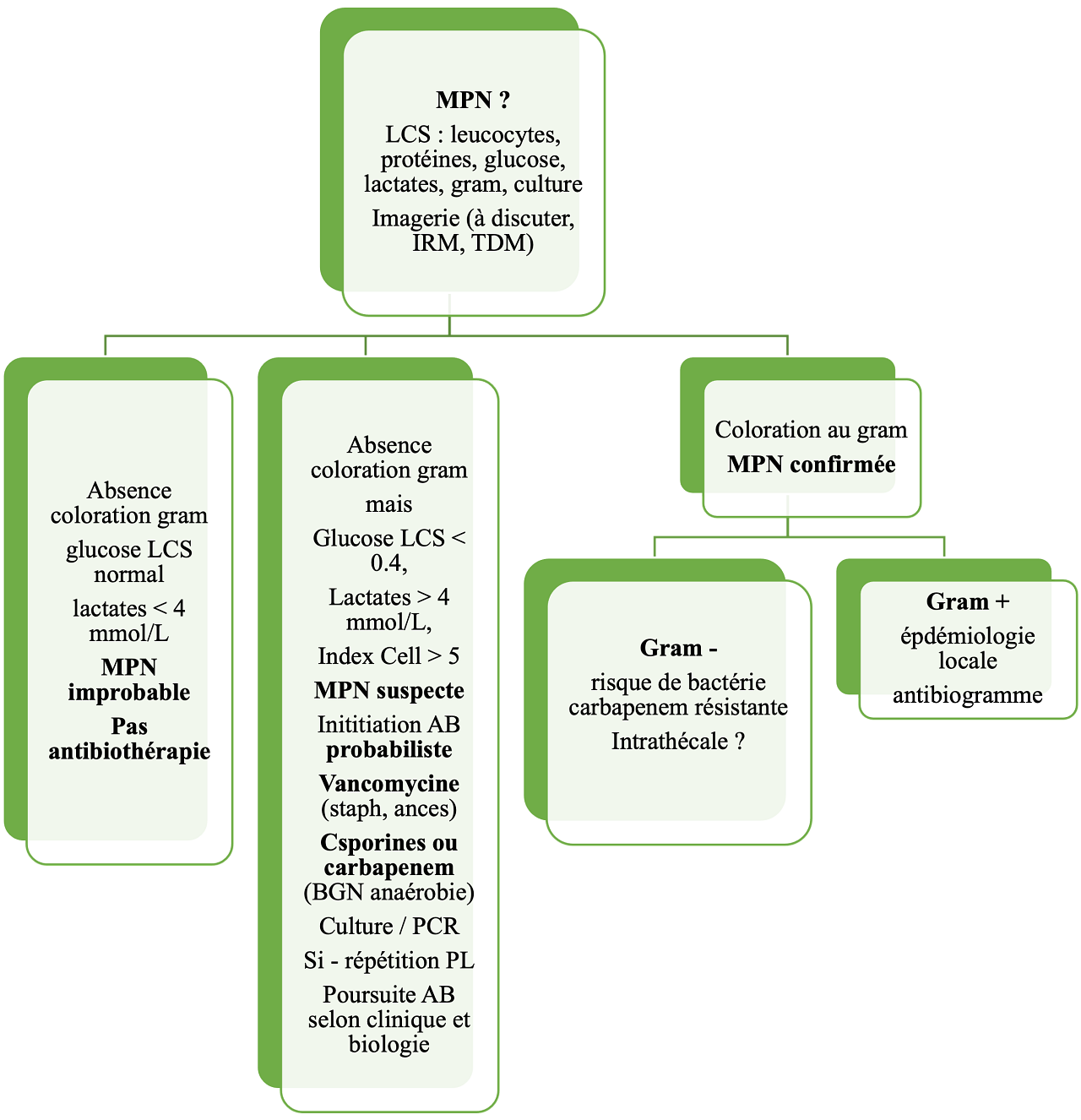
Les critères classiques de méningite - hyperleurocytose, hyperprotéinorachie et hypoglycorachie - sont d’une faible valeur prédictive du diagnostic de MPN. L’index - supérieur à 5 - du rapport leucocytes/erythrocytes dans le LCS sur celui dans le sang est uniquement indicatif. Le dosage des lactates (taux > 0.4 mmol/L) oriente le diagnostic mais un taux normal ne l’élimine pas complètement. Les marqueurs de l’infection bactérienne (procalcitonine, protéine C-réactive, interleukines, …) restent discutés.
L’incubation en culture du LCS doit être au moins de 10 jours mais un résultat négatif n’élimine pas le diagnostic. L’amélioration de la sensibilité des cultures par PCR reste controversée (9).
Une imagerie nécessaire
Plusieurs objectifs sous-tendent leur réalisation. Toute complication encéphalique (abcès, encéphalite) doit être éliminé. Le trouble hydrodynamique du LCS peut s’installer à bas bruit chez ces patients infectés parfois avec trouble de vigilance. La porte d’entrée sur la base du crâne doit être identifiée par la réalisation de TDM en coupes fines.
Proposition d’algorithme
Légende. AB, antibiotique ; MPN, méningite post-neurochirurgicale ; Index cell = leucocytes-LCS / érythrocytes-LCS divisé par leucocytes-sang / érythrocytes-sang ; LCS, liquide cérébro-spinal ; PL, ponction lombaire ;
Traitement
Antibiothérapie probabiliste
Adaptée selon l’écologie microbienne locale, les recommandations sont l’usage d’une vancomycine vis-à-vis du staphylocoque et de l’acnes, et, pour couvrir les BGN anaérobie, la prescription d’une céphalosporine antipseudomonas ou d’une carbapenem antipseudomonas (10). En cas d’allergie au B-lactamases, la Société Américaine d’Infectieuse recommande l’usage de fluoroquinolones ou aztreonam.
En cas de risque d’infection nosocomiale causée par A. Baumanii, la colistine doit être associé à une carbapenem.
Bactéries gram +
Que ce soit le staphylococcus aureus ou epidermidis, ils sont méthicilline résistant. Vancomycine est considérée comme le traitement de choix à 15-20mg/Kg en 2-3 administrations / jour (cible sérique : 15-20 mg/mL). A cause de leur faible franchissement de la barrière hémato-encéphalique, de leur toxicité hématologique et neurologique, teicoplanin, linezolid et tedizolid sont peu proposées. Les nouvelles céphalosporines seraient intéressantes.
Bactéries gram –
Les céphalosporines sont préférées sur les carbapenems. Pour ces dernières, le meropenem sera privilégié sur le miripenem en raison du faible risque épileptique.
La recrudescence de Acinetobacter Baumannii et Pseudomonas aeruginosa a renforcé l’intérêt de la colistin en association avec une carbapenem. L’usage du Chloramphenicol est actuellement exceptionnel.
Thérapie intrathécale
La faible pénétration des antibiotiques dans le LCS est commune. Elle est évaluée selon le degré d’inflammation méningée modérée et forte, respectivement de 4% et 30% pour les carbapenem et 5% et 11% pour la colistine (11).
La thérapie intrathécale serait proposée pour les MPN à BGN carbapenem résistante par usage d’aminoglycoside et pour les MPN à staphylococcus aureus methicillin-résistante par injection de vancomycin (2).
Systèmes de dérivation externe ou interne du LCS
A propos des dérivations ventriculaires externes (DVE), La réalisation systématique de prélèvements de LCS ou les changements programmés de cathéter ventriculaires ne sont pas recommandés (12).
La surinfection du matériel est liée à une colonisation bactérienne. Malgré la possible efficacité d’une antibiothérapie par voie systémique et intraventriculaire vis-à-vis d’une surinfection à staphylococcus coagulase négative (13), la règle est de retirer le matériel en passant par une période de DVE implantés après stérilisation du LCS permettant d’obtenir un taux de succès de 85% (3, 14).
Le timing de reimplantation du shunt après stérilisation serait de 7-10 jours d’anntibiothérapie adaptée après confirmation de stérilisation pour les staphylococci coagulase-négative et propionibactérium acnes, et 10-21 jours pour les infections BGN (10).
Video : Les méningites postopératoires et la gestion des implants.
Renaud Verdon.
Points forts
- Une présentation clinique abâtardie de la méningite post neurochirurgicale.
- Prédominance de staphylococci epdermidis, propionibacterium acnes, BNG.
- Ablation du matériel est recommandée.
- Antibiothérapie probabiliste : vancomycin.
Incertitudes
- Isolement du germe difficile.
- Efficacité de la thérapie intrathécale.
- Timing de réimplantation du matériel.
Réponses
1D, 2B, 3A, 4C, 5ABC.
Références annotées
Van de Beek D, Brouwer MC, Koedel U, Wall EC. Community-acquired bacterial meningitis. Lancet (London, England). 2021.
Revue actuelle de la méningite communautaire.
Hussein K, Bitterman R, Shofty B, Paul M, Neuberger A. Management of post-neurosurgical meningitis : narrative review. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2017 ;23(9):621-8
Guidelines sur le sujet édité par la société Européenne.
Tunkel AR, Hasbun R, Bhimraj A, Byers K, Kaplan SL, Scheld WM, et al. 2017 Infectious Diseases Society of America’s Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2017 ;64(6):e34-e65.
Guidelines sur le sujet édité par la société Américaine.
van de Beek D, Drake JM, Tunkel AR. Nosocomial bacterial meningitis. The New England journal of medicine. 2010 ;362(2):146-54.
Revue de littérature incontournable sur la méningite nosocomiale. Ce papier décrit les contours de la problématique, du diagnostic et du traitement de la MPN.
Références
1. van de Beek D, Brouwer MC, Koedel U, Wall EC. Community-acquired bacterial meningitis. Lancet (London, England). 2021.
2. Hussein K, Bitterman R, Shofty B, Paul M, Neuberger A. Management of post-neurosurgical meningitis : narrative review. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2017 ;23(9):621-8.
3. van de Beek D, Drake JM, Tunkel AR. Nosocomial bacterial meningitis. The New England journal of medicine. 2010 ;362(2):146-54.
4. Korinek AM, Baugnon T, Golmard JL, van Effenterre R, Coriat P, Puybasset L. Risk factors for adult nosocomial meningitis after craniotomy : role of antibiotic prophylaxis. Neurosurgery. 2008 ;62 Suppl 2:532-9.
5. Reichert MC, Medeiros EA, Ferraz FA. Hospital-acquired meningitis in patients undergoing craniotomy : incidence, evolution, and risk factors. American journal of infection control. 2002 ;30(3):158-64.
6. McClelland S, 3rd, Hall WA. Postoperative central nervous system infection : incidence and associated factors in 2111 neurosurgical procedures. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2007 ;45(1):55-9.
7. Wang X, Dong Y, Qi XQ, Li YM, Huang CG, Hou LJ. Clinical review : Efficacy of antimicrobial-impregnated catheters in external ventricular drainage - a systematic review and meta-analysis. Critical care (London, England). 2013 ;17(4):234.
8. Metan G, Alp E, Aygen B, Sumerkan B. Acinetobacter baumannii meningitis in post-neurosurgical patients : clinical outcome and impact of carbapenem resistance. The Journal of antimicrobial chemotherapy. 2007 ;60(1):197-9.
9. Rath PM, Schoch B, Adamzik M, Steinmann E, Buer J, Steinmann J. Value of multiplex PCR using cerebrospinal fluid for the diagnosis of ventriculostomy-related meningitis in neurosurgery patients. Infection. 2014 ;42(4):621-7.
10. Tunkel AR, Hasbun R, Bhimraj A, Byers K, Kaplan SL, Scheld WM, et al. 2017 Infectious Diseases Society of America’s Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2017 ;64(6):e34-e65.
11. Nau R, Sörgel F, Eiffert H. Penetration of drugs through the blood-cerebrospinal fluid/blood-brain barrier for treatment of central nervous system infections. Clinical microbiology reviews. 2010 ;23(4):858-83.
12. Fried HI, Nathan BR, Rowe AS, Zabramski JM, Andaluz N, Bhimraj A, et al. The Insertion and Management of External Ventricular Drains : An Evidence-Based Consensus Statement : A Statement for Healthcare Professionals from the Neurocritical Care Society. Neurocritical care. 2016 ;24(1):61-81.
13. Brown EM, Edwards RJ, Pople IK. Conservative management of patients with cerebrospinal fluid shunt infections. Neurosurgery. 2008 ;62 Suppl 2:661-9.
14. Pelegrín I, Lora-Tamayo J, Gómez-Junyent J, Sabé N, García-Somoza D, Gabarrós A, et al. Management of Ventriculoperitoneal Shunt Infections in Adults : Analysis of Risk Factors Associated With Treatment Failure. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2017 ;64(8):989-97.
15. Fragata I, Canto-Moreira N, Canhão P. Ischemic Lesions in Acute and Subacute Perimesencephalic Subarachnoid Hemorrhage. AJR American journal of roentgenology. 2019 ;212(2):418-24.