3.4.1 CONDUITE A TENIR DEVANT LA DECOUVERTE D’UNE TUMEUR CEREBRALE CHEZ L’ENFANT
QCM :
A. Devant la découverte d’une tumeur dans les voies d’écoulement du LCS au niveau de la fosse postérieure, une IRM médullaire doit être réalisée si possible avant le traitement de l’hydrocéphalie.
B. La découverte d’une tumeur pinéale impose la recherche de marqueurs sanguins et dans le LCS (Béta-transferrine et alpha-foetoprotéine)
C. La présence d’un foramen ovale perméable peut contre-indiquer la position opératoire en décubitus ventral
D. En cas d’hydrocéphalie associée à une tumeur du V4, la résection première de la tumeur pour lever l’obstacle est le traitement de première intention.
E. La présence d’une restriction du coefficient de diffusion au niveau de la tumeur en IRM oriente vers le diagnostic d’épendymome.
La pathologie en chiffres
1er cancer solide de l’enfant
Signes d’HTIC dans plus de 60% des cas au diagnostic. 1
Macrocrânie : présentation initiale majoritaire < 4 ans. 2
Fosse postérieure = localisation la plus fréquente entre 4 et 10 ans. 3
Memento didactique
Signes cliniques de présentation d’une tumeur cérébrale chez l’enfant :
1) Diagnostiquer le syndrome d’HTIC = premier mode de présentation toute localisation tumorale inclue
Reconnaître les particularités pédiatriques de l’HTIC (cf fiche hydrocéphalie tumorale chez l’enfant).
Recherche de signes de gravité de l’HTIC :
- Troubles de conscience (score de GCS < 15)
- atteinte hémodynamique
- signes d’engagement
- évaluation du caractère évolutif (aggravation <15j // stabilité chronique des signes)
Score de Glasgow pédiatrique
| Ouverture des yeux (id adulte) |
Réponse verbale (enfant < 5 ans) |
Réponse motrice (id adulte) |
| Spontanée (3) A la demande (2) A la douleur (1) |
Orientée (5) Mots (4) Sons (3) Cris (2) Aucune (1) |
A la demande (6) Orientée à la douleur (5) Evitement non adapté (4) Décortication (flexion à la douleur) (3) Décérébration (extension à la douleur) (2) Aucune (1) |
2) Signes d’atteinte focale à rechercher 2 :
| Localisation tumorale | Signes focaux classiquement au premier plan |
| Fosse postérieure | Nausées et vomissements Troubles de la marche et de la coordination Rechercher un torticolis : signe d’engagement cérébelleux transoccipital (dans le foramen magnum) |
| Supratentorielle | Déficit sensitif/moteur (aspécifique) Epilepsie |
| Noyaux Gris Centraux | Mouvements oculaires anormaux et strabisme |
| Tronc cérébral | Troubles de la marche et de la coordination Atteinte des paires crâniennes (aspécifique) Syndrome pyramidal (aspécifique) |
| Suprasellaire | Signes cliniques de déficit endocrinien Anomalie du champ visuel, baisse d’acuité visuelle |
3) Recherche d’arguments pour un syndrome de prédisposition génétique dans les ATCD 4
| Syndrome de prédisposition | Tumeurs du Système Nerveux Central | Signes à rechercher en cas de suspicion chez le patient / sa famille |
| NF1 | Gliome de bas grade (voies optiques +) | Tâches pigmentées (café au lait), neurofibromes cut/ss-cut, nodules de Lisch (iris) |
| STB | SEGA, Gliomes de bas grade | Macules hypomélanotiques, angiofibromes cutanés |
| Syndrome de Gorlin | MB (SHH) | Dysmorphie faciale, carcinomes basocellulaires |
| Syndrome de Lynch | Gliome de haut grade | Tumeurs de localisation multiple (digestive, urologique, gynéco) |
| Syndrome de Turcot | MB (WNT) | Polypose colique, cancer colorectal, lésions pigmentées au FO |
| Syndrome de Li Fraumeni | Gliome de haut grade, Carcinome des plexus choroïdes, MB (SHH) | Tumeurs de localisation multiple (sein, tissus mous, os, surrénale, hémato) |
| NF2 | Ependymome, Méningiome, Schwannome | Tumeurs cutanées, baisse d’acuité visuelle |
NF1 : Neurofibromatose de type 1 ; STB : Sclérose Tubéreuse de Bourneville ; SEGA : Subependymal Giant cell Astrocytoma ; MB : Médulloblastome ; SHH : sous type dépednant de la voie Sonic Hedgehog ; WNT : sous type dépendant de la voie Wingless ; FO : fond d’œil ; NF2 : Neurofibromatose de type 2
Bilan paraclinique devant une suspicion de tumeur cérébrale de l’enfant
1) Diagnostique positif : l’IRM cérébrale
L’IRM cérébrale avec injection doit toujours compléter le scanner cérébral encore souvent réalisé dans les services d’urgence en première intention comme examen « de débrouillage » (attention à l’analyse de la fosse postérieure sur ce scanner).
Elle permet :
- Le diagnostic positif
- De préciser la localisation tumorale
- De poser le diagnostic de complications associées : hydrocéphalie, engagement cérébral/cérébelleux, saignement intratumoral
- De réaliser le bilan d’extension locale
- De proposer des hypothèses diagnostiques anatomopathologique
Présentations radiologiques classiques des principales tumeurs de fosse postérieure
| Astrocytome pilocytique | Tumeur au sein du parenchyme cérébelleux Kystique avec bourgeon charnu prenant le contraste Effet de masse sur le V4 qui est déformé, pas comblé Faible densité cellulaire : pas de restriction de diffusion à l’IRM |
| Médulloblastome | Tumeur d’origine vermienne Hétérogène (kyste, calcifications, nécrose) Se développant dans le V4 Hypercellulaire (spontanément hyperdense au scanner, restriction de diffusion en IRM) Prise de contraste hétérogène |
| Ependymome | Tumeur du V4 Extension « en languettes » dans les espaces sous arachnoïdiens (Luschka, Magendie, Aqueduc de sylvius) : s’adapte au « contenant » Calcifications fréquentes |
2) Démarche diagnostique étiologique spécifique par localisation
| Tumeur pinéale | Recherche de marqueurs tumoraux dans le LCS et le sang (αFP et βHCG : tumeurs germinales sécrétantes ?) : réalisable au cours de la VCS parfois associée à une biopsie endoscopique de la tumeur |
| Tumeur diffuse du tronc cérébral | Caractéristiques radiologiques typiques du Gliome Diffus du Tronc Cérébral retrouvées à l’IRM : pas de preuve anatomopathologique nécessaire avant traitement par radiothérapie (biopsie proposée dans le cadre de protocoles de recherche) |
3) Bilan d’extension spécifique par localisation
| Tumeur dans les voies d’écoulement du LCS (V4+) | IRM médullaire (dans l’idéal avant le traitement chirurgical de l’hydrocéphalie) PL à la recherche de cellules tumorales à distance de la chirurgie tumorale |
| Tumeur suprasellaire | bilan ophtalmologique : champ visuel et acuité visuelle bilan endocrinien hypophysaire |
4) Bilan pré opératoire
Bilan biologique pré opératoire : toujours anticiper la transfusion (masse sanguine bien inférieure en pédiatrie : 85ml/kg pour un nouveau né à terme)
Discuter la réalisation d’une échocardiographie cardiaque à la recherche d’un foramen ovale perméable dans l’hypothèse d’une chirurgie d’exérèse de tumeur de fosse postérieure en position assise (selon avis/habitude de l’équipe d’anesthésie du centre)
Prise en charge thérapeutique :
1) Traitement symptomatique :
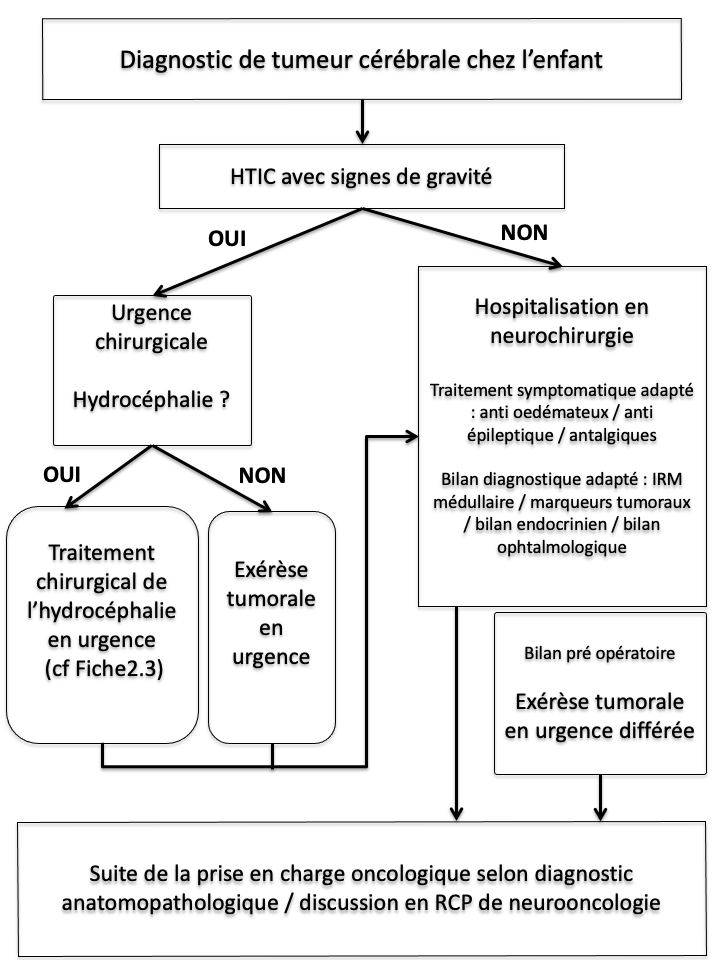
Si HTIC aigue / signes de gravité : levée de l’HTIC = urgence chirurgicale
- Si hydrocéphalie : prise en charge en urgence de l’hydrocéphalie (cf fiche hydrocéphalie tumorale chez l’enfant)
- Si pas d’hydrocéphalie : exérèse chirurgicale en urgence
Corticothérapie :
- Si œdème périlésionnel à l’imagerie, en attendant l’exérèse chirurgicale
- Ex : Méthylprednisolone 1 à 2mg/kg en bolus IV, jusqu’à 3 bolus par jour + mesures associées
Traitement antiépileptique : - non indiqué en prophylaxie, à introduire si crises d’épilepsie (EEG à réaliser si doute clinique, avec avis spécialisé)
- Ex : Levetiracetam sirop : 1-6 mois : 7 à 21 mg/kg 2 fois par jour 6 mois : 10 à 30 mg/kg 2 fois par jour
Prise en charge antalgique adaptée
2) Traitement étiologique
Exérèse chirurgicale
Premier temps du traitement oncologique dans la grande majorité des tumeurs cérébrales pédiatriques.
Objectif oncologique du premier temps chirurgical : étendue de résection maximale sans prise de risque d’aggravation de l’état neurologique de l’enfant.
Traitement adjuvant
Systématiquement discutés en réunion de concertation pluridisciplinaire de neuro-oncologie.
Algorithme décisionnel
Figure 1 : CAT tumeur cérébrale de l’enfant
Réponses QCM :
A
Références annotées
1- Lanphear, Jackson, et Syana Sarnaik. « Presenting Symptoms of Pediatric Brain Tumors Diagnosed in the Emergency Department » : Pediatric Emergency Care 30, no 2 (février 2014) : 77 80. https://doi.org/10.1097/PEC.0000000000000074.
2- Wilne, Sophie, Jacqueline Collier, Colin Kennedy, Karin Koller, Richard Grundy, et David Walker. « Presentation of Childhood CNS Tumours : A Systematic Review and Meta-Analysis ». The Lancet. Oncology 8, no 8 (août 2007) : 685 95. https://doi.org/10.1016/S1470-2045(07)70207-3.
3- Udaka, Yoko T., et Roger J. Packer. « Pediatric Brain Tumors ». Neurologic Clinics 36, no 3 (août 2018) : 533 56. https://doi.org/10.1016/j.ncl.2018.04.009.
4- Malbari, Fatema, et Holly Lindsay. « Genetics of Common Pediatric Brain Tumors ». Pediatric Neurology 104 (mars 2020) : 3 12. https://doi.org/10.1016/j.pediatrneurol.2019.08.004.
5- Kerleroux, Basile, Jean Philippe Cottier, Kévin Janot, Antoine Listrat, Dominique Sirinelli, et Baptiste Morel. « Posterior Fossa Tumors in Children : Radiological Tips & Tricks in the Age of Genomic Tumor Classification and Advance MR Technology ». Journal of Neuroradiology = Journal De Neuroradiologie 47, no 1 (février 2020) : 46 53. https://doi.org/10.1016/j.neurad.2019.08.002.
6- Pollack, Ian F., Sameer Agnihotri, et Alberto Broniscer. « Childhood Brain Tumors : Current Management, Biological Insights, and Future Directions ». Journal of Neurosurgery. Pediatrics 23, no 3 (1 mars 2019) : 261 73. https://doi.org/10.3171/2018.10.PEDS18377.
Références : pour aller plus loin
Classification moléculaire des tumeurs cérébrale pédiatriques
Cacciotti, Chantel, Adam Fleming, et Vijay Ramaswamy. « Advances in the Molecular Classification of Pediatric Brain Tumors : A Guide to the Galaxy ». The Journal of Pathology 251, no 3 (juillet 2020) : 249 61. https://doi.org/10.1002/path.5457.