3.1.1 Les anévrismes intracrâniens non rompus
Laurent Thines, M.D. Ph.D., Service de neurochirurgie, CHRU de Besançon, septembre 2020
Questions
QCM 1 : Les facteurs de risque modifiables de promotion des anévrismes intracrâniens sont :
a. Hypercholestérolémie
b. Tabagisme
c. Alcoolisme
d. Diabète
e. Hypertension artérielle
QCM 2 : Le développement d’un anévrisme intracrânien peut être lié à :
a. Des prédispositions personnelles (sexe, génétique)
b. Des variantes de l’anatomie artérielle (fenestration)
c. Un stress hémodynamique (bifurcation, angulation)
d. Des mécanismes biologiques (apoptose)
e. Une activité physique trop importante
QCM 3 : Les anévrismes intracrâniens non rompus
a. Sont fréquemment diagnostiqués par des symptômes révélateurs
b. Peuvent se manifester par une crise convulsive
c. Peuvent se manifester par un accident ischémique
d. Doivent être pris en charge de façon multidisciplinaire
e. Ont un risque faible de rupture à court terme quelle que soit leur taille
QCM 4 : Les éléments en faveur du traitement d’un anévrisme intracrânien non rompu sont :
a. Le jeune âge du patient
b. La présence de comorbidités importantes
c. Son caractère instable (croissance, symptomatique)
d. Une taille inférieure à 5 mm
e. Un antécédent de saignement d’un autre anévrisme
Memento didactique
1. Définition
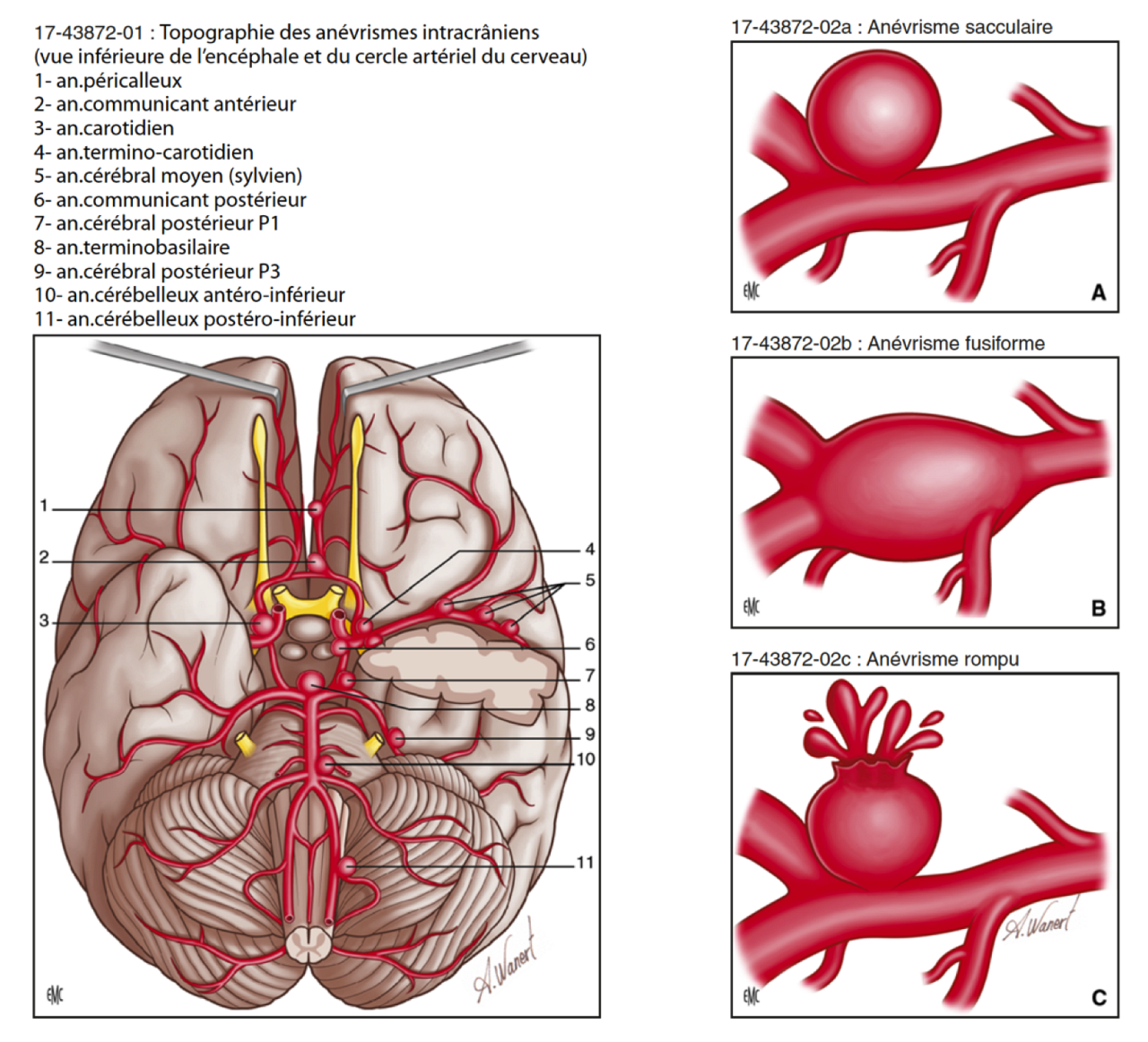
L’anévrisme intracrânien (AI) est défini par l’existence d’une dilatation anormale (> 1mm) et permanente de la paroi d’une artère cérébrale intracrânienne touchant ses 3 tuniques, qui peuvent être altérées à des degrés divers, mais restant circonscrite au moins par la couche adventitielle externe. Ils se développent préférentiellement au niveau des bifurcations des artères du cercle artériel du cerveau (polygone de Willis) (Figure 1-1).
Dans leur forme classique (85%), les AI sont sacciformes (Figure 1-2a). Certains anévrismes (15%) sont au contraire fusiformes (Figure 1-2b) et constitués d’une dilatation globale, plus ou moins symétrique, de la paroi artérielle selon son axe principal.
2. Histologie
Les AI sacciformes classiques sont formés d’une hernie de l’intima au travers d’un défect acquis de la media (couche musculaire lisse) de la paroi artérielle. Au niveau de leur collet, la limitante élastique interne disparaît, et s’associe parfois à une hyperplasie myo-intimale [9]1. Ils sont recouverts en périphérie de l’adventice artérielle composée d’expansions de collagène multidirectionnelles 2.
3. Epidémiologie
L’AI représente une pathologie neurovasculaire relativement commune puisque 2 à 5% des adultes en seraient porteurs 3. Ils sont le plus souvent découverts de façon fortuite par des techniques d’imagerie non invasive (IRM, angioscanner). Dans de rares cas (AI de gros volume), ils peuvent donner des symptômes : syndrome pseudo-tumoral, crise d’épilepsie, AVC emboliques. La question des céphalées liées aux AI non rompus non géants reste controversée.
VIDEO 2017, Clinique des anévrysmes non rompus. François Proust
L’âge moyen au diagnostique est de 60 ans, et l’incidence augmente avec l’âge 4-7. En revanche, l’évolution vers la rupture de ces AI reste une éventualité rare (environ 6.000 cas par an en France, 10 pour 100.000 habitants/an) et l’hémorragie méningée ou sous-arachnoïdienne (HSA), qui en résulte, représente à peine 7 % de l’ensemble des accidents vasculaires cérébraux (AVC) 8-10. Néanmoins, la survenue fréquente à un âge relativement jeune et le pronostic de ces accidents (30% de mortalité, 40-50% de handicap neurologique) ont un impact sévère en termes de santé publique, avec en particulier une perte d’années de vie productive pour le pays similaire à celle de pathologies plus fréquentes comme les AVC ischémiques 8,11-13
4. Physiopathologie
La genèse et la croissance des AI font appel à des processus complexes, non encore totalement élucidés et qui impliquent la conjugaison des effets de facteurs prédisposant, de phénomènes biomécaniques et de processus biologiques. L’idée d’une fragilité pariétale sous-jacente et d’origine congénitale reste très controversée 14,15.
VIDEO 2017, Anévrysmes intra-craniens : Initiation - Croissance - Rupture. Pierre-Hughes Roche
La lésion inaugurale, pré-anévrismale, nécessaire au développement d’un AI est d’étiologie inconnue. C’est sur cette dilatation originelle de la paroi que vont interagir des phénomènes aussi bien biomécaniques que biologiques et qui vont progressivement aboutir à la formation puis à la croissance d’un véritable anévrisme artériel. Des forces de cisaillement pariétales élevées, favorisées par une vélocité sanguine et une pression artérielle augmentées, ou un angle d’impact de flux prédisposant (bifurcation, axe du vaisseau porteur, rapport sac/collet, malformation artério-veineuse (MAV) associée et hyperdébit local) 16-18, vont induire la genèse et la croissance anévrismale par rupture de la limitante élastique interne, réorganisation des fibres de collagènes et atrophie progressive de la média.
Une fois l’anévrisme constitué, c’est au niveau des zones où les forces de cisaillement seront à l’inverse les plus basses au sein du sac anévrismal (dynamique de flux hétérogène) que vont se former des zones de fragilité pariétales (phlyctènes) conduisant à la rupture 19-21. En parallèle, la dégradation de la paroi se poursuit et se traduit par une hyperdéformabilité (réorientation des fibres de collagènes) et par l’abaissement du seuil mécanique de résistance à la rupture jusqu’à un point limite. Lorsque celui-ci est atteint, une augmentation brève de la pression artérielle va pouvoir provoquer l’effraction de la paroi – rupture anévrismale (Figure 1-2c) et l’irruption brutale du sang dans les espaces intracrâniens
VIDEO 2016, JNE. Physiopathologie de la rupture L.Thines
VIDEO 2017. La rupture anévrysmale. Laurent Thines
5. Facteurs de risque
Des facteurs de risque endogènes ont été mis en évidence comme le sexe ou certaines maladies génétiques : maladies du tissu conjonctif (moindre résistance mécanique) ou syndrome des anévrismes familiaux.
Ainsi, les femmes portent un risque accru d’HSA avec un sex-ratio aux alentours de 1,2 à 1,6 suivant la région d’origine et cela essentiellement en raison de la prévalence des AI chez elles 4-8.
La définition d’anévrisme familial est le plus souvent restreinte aux familles comportant au moins deux parents au premier degré porteurs d’AI rompus ou non rompus (ex : un patient diagnostiqué et ayant un parent connu pour être porteur de la maladie) 22. Les modes de transmission sont très variables (autosomique récessif, autosomique dominant sans ou avec pénétrance variable) et aucun gène n’a été à ce jour clairement identifié 8,23-28. Les membres de ces familles ont 4,2 fois plus de risque d’être atteint d’AI non rompus (incidence 8%, souvent multiples), sont exposés à un risque accru et précoce d’HSA (1,2% par an, RR = 4), et sont plus susceptibles aux facteurs favorisants comme le sexe féminin, le tabac ou l’alcool 8, 29-31 .
Certaines maladies génétiques touchant le tissu conjonctif sont associées à un risque plus élevé d’AI et d’HSA comme : la polykystose rénale autosomique dominante (PKRAD, mutation de la polycystine), la maladie d’Ehlers-Danlos (anomalie du collagène de type 3), la maladie de Marfan (déficit en fibrilline), le pseudoxanthoma elasticum (fragmentation des fibres élastiques), la dysplasie fibromusculaire (déficit en 1-antitrypsine), la neurofibromatose de type 1 32-34 . En fait, en dehors de certains sous-groupes familiaux de PKRAD (histoire familiale d’HSA et risque accru de rupture des anévrismes à un jeune âge), l’incidence des AI rompus est assez faible dans les autres pathologies 28.
Des facteurs exogènes ont également été identifiés et amplifient une éventuelle susceptibilité génétique sous-jacente. Les principaux d’entre eux sont le tabac, l’alcool et l’hypertension artérielle (HTA).
Le tabagisme est le facteur de risque principal d’HSA, il est retrouvé chez 75% des patients présentant une rupture anévrismale et fréquemment en relation avec des AI multiples 35-37.
L’hypertension artérielle est le second facteur de risque d’HSA, retrouvé chez 20% des patients présentant une rupture anévrismale, et augmente ce risque par 2,5 35,38,39 .
La consommation excessive d’alcool (> 150 g/j) multiplie le risque d’HSA anévrismale par 2 38,39.
6. Prise en charge
Les paramètres suivants doivent être pris en compte pour parvenir à une estimation individuelle du risque de rupture : âge, sexe, antécédents personnel d’HSA ou familial d’AI, caractère instable (symptomatique ou évolutif) ou non, et données anatomiques de l’AI (taille et localisation essentiellement, morphologie - phlyctènes, irrégularités - et orientation par rapport au flux à un moindre degré). Le risque annuel de rupture tous AI confondus est d’environ 1% par an. Le risque de saigner d’un AI non rompu augmente avec la présence d’un antécédent d’HSA par rupture d’un autre AI, la taille de l’anévrisme ou sa situation en circulation postérieure (système vertébro-basilaire, VB) plutôt qu’antérieure. Ce risque peut atteindre 40 à 50% à 5ans pour les anévrismes géants (> 25 mm) suivant leur localisation antérieure ou postérieure sur le polygone de Willis 40 .
Il est plus élevé pour les AI >5mm, les AI de la circulation postérieure (incluant les anévrismes postéro-carotidiens) et les AI symptomatiques (hors HSA), et en revanche très faible pour les petits anévrismes (< 5mm) de la circulation antérieure (<<1% par an) 9. Le sexe féminin et le tabagisme sont des facteurs aggravants.
La balance bénéfice-risque d’une prise en charge interventionnelle (embolisation ou microchirurgie) prend en compte ce risque évolutif mais aussi les risques du traitement (comorbidités, morbi-mortalité, durabilité). Elle doit s’évaluer de façon pluridisciplinaire.
VIDEO 2016, JNE. Résultats de la chirurgie, de l’embolisation. ISAT. Synthèse Thierry Civit
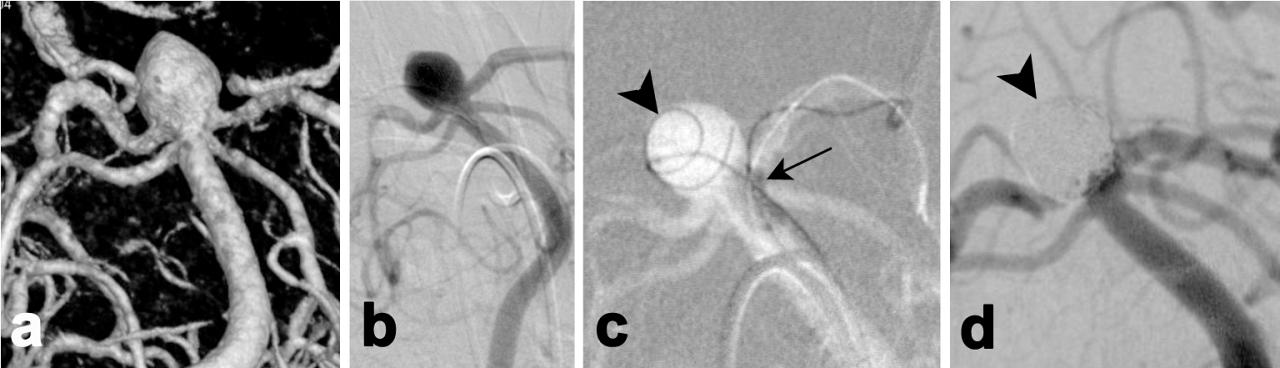
– le traitement endovasculaire (embolisation par coils, flowdisrupters endosacculaires, stents) doit être proposé en première intention si il est techniquement possible, avec un risque prévisible faible de complications et une chance élevée d’occlusion complète de l’anévrisme équivalente au traitement chirurgical.
VIDEO 2017, Traitement endovasculaire des anévrismes cérébraux. F. Ricolfi
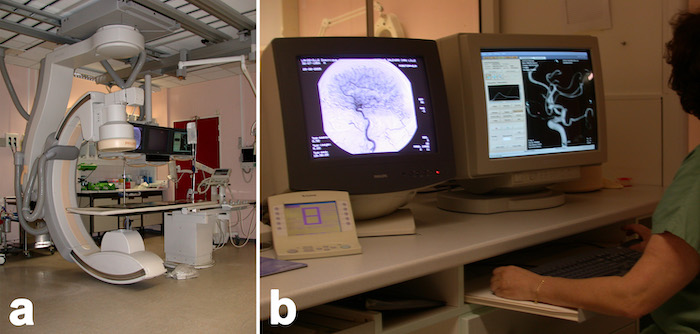
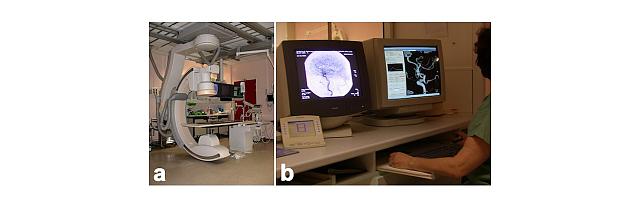
Figure 2 – Salle d’embolisation
Figure 3 – embolisation par coils d’un anévrisme du tronc basilaire
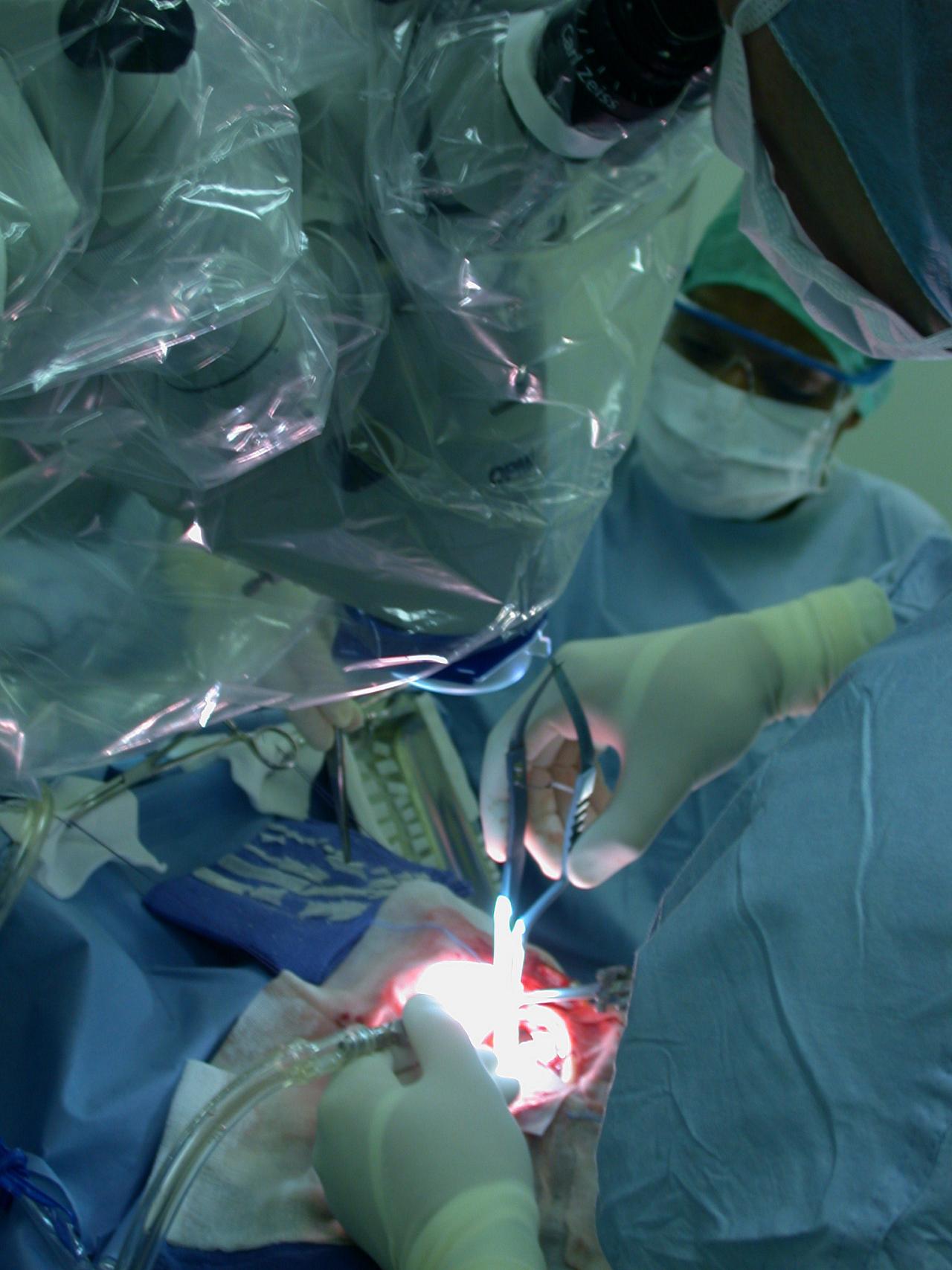
– l’exclusion microchirurgicale par clippage reste une excellente alternative surtout pour les anévrismes de la circulation antérieure et chez des patients jeunes où la durabilité du traitement est recherchée.
VIDEO 2016, JNE. Dissection et exclusion par clip J.-P. Lejeune
Figure 4 – Chirurgie d’anévrisme sous microscope
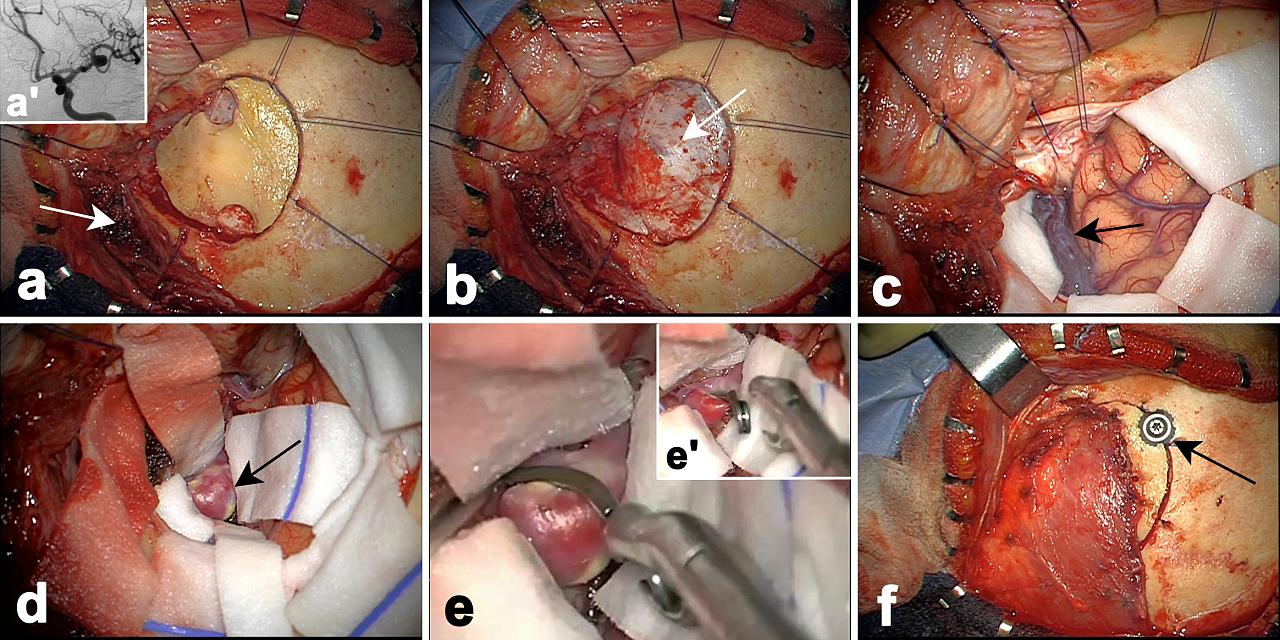
Figure 5 – a,b : craniotomie c : abord sylvien d : exposition de l’anévrisme e : mise en place du clip (clippage) f : fermeture
7. Prévention
La prévention de la maladie anévrismale à l’échelle de la population passe par l’éviction des facteurs de risque modifiables de promotion des AI et le suivi clinico-radiologique (angio-IRM, angioscanner) des patients à risque ou préalablement traités.
Points forts
– l’AI est une dilatation permanente > 1mm, touchant les 3 tuniques de l’artère et circonscrite par une couche adventitielle.
– le développement d’un AI fait intervenir des phénomènes biomécaniques (dynamique de flux, forces de cisaillement) et biologiques (inflammation, apoptose)
– les facteurs de risque modifiables de développement des AI sont le tabac, l’HTA et l’alcool et les facteurs congénitaux de développement des AI sont le sexe ou certaines maladies génétiques (anévrismes familiaux, polykystose rénale) : le risque d’AI est accru selon : sexe féminin x 5, anévrismes familiaux x 4, PKRAD x 2-3, tabagisme x 3-4, HTA x 2,5, alcoolisme x 2
– l’incidence annuelle en France de l’HSA anévrismale est d’environ 10 / 100000 habitants.
– les AI non rompus peuvent être symptomatiques (40%) par : atteinte des nerfs crâniens, syndrome pseudo-tumoral, crise d’épilepsie, AVC ischémique, céphalée
– le risque de rupture d’un AI non rompu dépend de : sexe, antécédent d’HSA, antécédent familial d’AI, taille et localisation de l’AI, caractère instable de l’AI
– la décision de prise en charge doit être collégiale et multidisciplinaire associant neurochirurgien vasculaire, neurologue vasculaire et neuradiologue interventionnel
– la prévention est basée sur l’éviction des facteurs de risque modifiables : tabac, HTA, alcool
– il n’y a pas de recommandations scientifiques concernant le mode de vie ou la gestion des grossesses ou accouchements chez les patients porteurs d’un AI
– un dépistage doit être proposé en cas d’anévrismes familiaux ou de PKRAD avec histoire familiale d’HSA (ARM)
– les AI non rompus ou les AI traités doivent être suivis régulièrement sur le plan clinique et radiologique (ARM ou angioscanner)
Points faibles
– il est à l’heure actuelle impossible d’évaluer ou de mesurer formellement le risque individuel de rupture d’un anévrisme donné chez un patient donné et la réflexion sur la balance bénéfice-risque du traitement reste encore probabiliste.
Réponses aux questions
QCM 1 : Les facteurs de risque modifiables de promotion des anévrismes
a. Hypercholestérolémie
b. Tabagisme
c. Alcoolisme
d. Diabète
e. Hypertension artérielle
Réponse : b,c,e
QCM 2 : Le développement d’un anévrisme intracrânien peut être lié à :
a. Des prédispositions personnelles (sexe, génétique)
b. Des variantes de l’anatomie artérielle (fenestration)
c. Un stress hémodynamique (bifurcation, angulation)
d. Des mécanismes biologiques (apoptose)
e. Une activité physique trop importante
Réponse : a,b,c,d
QCM 3 : Les anévrismes intracrâniens non rompus
a. Sont fréquemment diagnostiqués par des symptômes révélateurs
b. Peuvent se manifester par une crise convulsive
c. Peuvent se manifester par un accident ischémique
d. Doivent être pris en charge de façon multidisciplinaire
e. Ont un risque faible de rupture à court terme quelle que soit leur taille
Réponse : b,c,d
QCM 4 : Les éléments en faveur du traitement d’un anévrisme intracrânien non rompu sont :
a. Le jeune âge du patient
b. La présence de comorbidités importantes
c. Son caractère instable (croissance, symptomatique)
d. Une taille inférieure à 5 mm
e. Un antécédent de saignement d’un autre anévrisme
Réponse : a,c,e
Références annotées
Steiner T, Juvela S, Unterberg A, Jung C, Forsting M, Rinkel G. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis 2013 ;35:93-112
Recommandations de la Société Européenne sur l’AVC.
Bederson JB, Connolly ES, Jr., Batjer HH, Dacey RG, Dion JE, Diringer MN, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage : a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke 2009 ;40:994-1025
Recommandations de la Société Nord-Américaine sur l’AVC.
Feigin VL, Lawes CM, Bennett DA, Anderson CS. Stroke epidemiology : a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century. Lancet Neurol 2003 ;2:43-53
Données épidémiologiques exhaustives
Wiebers DO, Whisnant JP, Huston J, III, Meissner I, Brown RD, Jr., Piepgras DG, et al. Unruptured intracranial aneurysms : natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet 2003 ;362:103-110
Article de référence sur les anévrismes intracrâniens non rompus.
L Thines , Anévrismes artériels intracrâniens - Neurologie 17-490-B-10 ; Encyclopédie Médico-Chirurgicale, Paris, 2015
Article complet dans l’EMC sur l’anévrisme intracrânien non rompu et rompu.
Références
1. Frosen J, Piippo A, Paetau A, Kangasniemi M, Niemela M, Hernesniemi J, et al. Remodeling of saccular cerebral artery aneurysm wall is associated with rupture : histological analysis of 24 unruptured and 42 ruptured cases. Stroke 2004 ;35:2287-2293
2. Mizutani T, Kojima H. Clinicopathological features of non-atherosclerotic cerebral arterial trunk aneurysms. Neuropathology 2000 ;20:91-97
3. Steiner T, Juvela S, Unterberg A, Jung C, Forsting M, Rinkel G. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis 2013 ;35:93-112
4. de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ. Incidence of subarachnoid haemorrhage : a systematic review with emphasis on region, age, gender and time trends. J Neurol Neurosurg Psychiatry 2007 ;78:1365-1372
5. Roos YB, de Haan RJ, Beenen LF, Groen RJ, Albrecht KW, Vermeulen M. Complications and outcome in patients with aneurysmal subarachnoid
6. Linn FH, Rinkel GJ, Algra A, van Gijn J. Headache characteristics in subarachnoid haemorrhage and benign thunderclap headache. J Neurol Neurosurg Psychiatry 1998 ;65:791-793
7. Molyneux A, Kerr R, Stratton I, Sandercock P, Clarke M, Shrimpton J, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms : a randomised trial. Lancet 2002 ;360:1267-1274
8. Bederson JB, Connolly ES, Jr., Batjer HH, Dacey RG, Dion JE, Diringer MN, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage : a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke 2009 ;40:994-1025
9. Wermer MJ, van dSI, Algra A, Rinkel GJ. Risk of rupture of unruptured intracranial aneurysms in relation to patient and aneurysm characteristics : an updated meta-analysis. Stroke 2007 ;38:1404-1410
10. Feigin VL, Lawes CM, Bennett DA, Anderson CS. Stroke epidemiology : a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century. Lancet Neurol 2003 ;2:43-53
11. Johnston SC, Selvin S, Gress DR. The burden, trends, and demographics of mortality from subarachnoid hemorrhage. Neurology 1998 ;50:1413-1418
12. van Gijn J, Rinkel GJ. Subarachnoid haemorrhage : diagnosis, causes and management. Brain 2001 ;124:249-278
13. Kowalski RG, Claassen J, Kreiter KT, Bates JE, Ostapkovich ND, Connolly ES, et al. Initial misdiagnosis and outcome after subarachnoid hemorrhage. JAMA 2004 ;291:866-869
14. da Costa L, Wallace MC, Ter Brugge KG, O’Kelly C, Willinsky RA, Tymianski M. The natural history and predictive features of hemorrhage from brain arteriovenous malformations. Stroke 2009 ;40:100-105
15. Stehbens WE. Etiology of intracranial berry aneurysms. J Neurosurg 1989 ;70:823-831
16. Steiger HJ, Poll A, Liepsch DW, Reulen HJ. Haemodynamic stress in terminal aneurysms. Acta Neurochir (Wien) 1988 ;93:18-23
17. Valencia A, Morales H, Rivera R, Bravo E, Galvez M. Blood flow dynamics in patient-specific cerebral aneurysm models : the relationship between wall shear stress and aneurysm area index. Med Eng Phys 2008 ;30:329-340
18. Hoi Y, Meng H, Woodward SH, Bendok BR, Hanel RA, Guterman LR, et al. Effects of arterial geometry on aneurysm growth : three-dimensional computational fluid dynamics study. J Neurosurg 2004 ;101:676-681
19. Tateshima S, Murayama Y, Villablanca JP, Morino T, Nomura K, Tanishita K, et al. In vitro measurement of fluid-induced wall shear stress in unruptured cerebral aneurysms harboring blebs. Stroke 2003 ;34:187-192
20. Shojima M, Oshima M, Takagi K, Torii R, Hayakawa M, Katada K, et al. Magnitude and role of wall shear stress on cerebral aneurysm : computational fluid dynamic study of 20 middle cerebral artery aneurysms. Stroke 2004 ;35:2500-2505
21. Pentimalli L, Modesti A, Vignati A, Marchese E, Albanese A, Di Rocco F, et al. Role of apoptosis in intracranial aneurysm rupture. J Neurosurg 2004 ;101:1018-1025
22. Ruigrok YM, Rinkel GJ, Wijmenga C, Van Gijn J. Anticipation and phenotype in familial intracranial aneurysms. J Neurol Neurosurg Psychiatry 2004 ;75:1436-1442
23. Wang MC, Rubinstein D, Kindt GW, Breeze RE. Prevalence of intracranial aneurysms in first-degree relatives of patients with aneurysms. Neurosurg.Focus. 2002 ;13:e2
24. Foroud T, Sauerbeck L, Brown R, Anderson C, Woo D, Kleindorfer D, et al. Genome screen in familial intracranial aneurysm. BMC Med Genet 2009 ;10:3
25. Ruigrok YM, Rinkel GJ. Genetics of intracranial aneurysms. Stroke 2008 ;39:1049-1055
26. Krischek B, Inoue I. The genetics of intracranial aneurysms. J.Hum.Genet. 2006 ;51:587-594
27. Verlaan DJ, Dube MP, St-Onge J, Noreau A, Roussel J, Satge N, et al. A new locus for autosomal dominant intracranial aneurysm, ANIB4, maps to chromosome 5p15.2-14.3. J Med Genet 2006 ;43:e31
28. Wills S, Ronkainen A, van der Voet M, Kuivaniemi H, Helin K, Leinonen E, et al. Familial intracranial aneurysms : an analysis of 346 multiplex Finnish families. Stroke 2003 ;34:1370-1374
29. Broderick JP, Brown RD, Jr., Sauerbeck L, Hornung R, Huston J, 3rd, Woo D, et al. Greater rupture risk for familial as compared to sporadic unruptured intracranial aneurysms. Stroke 2009 ;40:1952-1957
30. Lee JS, Park IS, Park KB, Kang DH, Lee CH, Hwang SH. Familial intracranial aneurysms. J Korean Neurosurg Soc 2008 ;44:136-140
31. Brown BM, Soldevilla F. MR angiography and surgery for unruptured familial intracranial aneurysms in persons with a family history of cerebral aneurysms. AJR Am.J.Roentgenol. 1999 ;173:133-138
32. Ring T, Spiegelhalter D. Risk of intracranial aneurysm bleeding in autosomal-dominant polycystic kidney disease. Kidney Int. 2007 ;72:1400-1402
33. Rossetti S, Chauveau D, Kubly V, Slezak JM, Saggar-Malik AK, Pei Y, et al. Association of mutation position in polycystic kidney disease 1 (PKD1) gene and development of a vascular phenotype. Lancet 2003 ;361:2196-2201
34. Torres VE, Cai Y, Chen X, Wu GQ, Geng L, Cleghorn KA, et al. Vascular expression of polycystin-2. J.Am.Soc.Nephrol. 2001 ;12:1-9
35. Kissela BM, Sauerbeck L, Woo D, Khoury J, Carrozzella J, Pancioli A, et al. Subarachnoid hemorrhage : a preventable disease with a heritable component. Stroke 2002 ;33:1321-1326
36. Weir BK, Kongable GL, Kassell NF, Schultz JR, Truskowski LL, Sigrest A. Cigarette smoking as a cause of aneurysmal subarachnoid hemorrhage and risk for vasospasm : a report of the Cooperative Aneurysm Study. J.Neurosurg. 1998 ;89:405-411
37. Qureshi AI, Suarez JI, Parekh PD, Sung G, Geocadin R, Bhardwaj A, et al. Risk factors for multiple intracranial aneurysms. Neurosurgery 1998 ;43:22-26
38. Feigin VL, Rinkel GJ, Lawes CM, Algra A, Bennett DA, van Gijn J, et al. Risk factors for subarachnoid hemorrhage : an updated systematic review of epidemiological studies. Stroke 2005 ;36:2773-2780
39. Teunissen LL, Rinkel GJ, Algra A, van Gijn J. Risk factors for subarachnoid hemorrhage : a systematic review. Stroke 1996 ;27:544-549
40. Wiebers DO, Whisnant JP, Huston J, III, Meissner I, Brown RD, Jr., Piepgras DG, et al. Unruptured intracranial aneurysms : natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet 2003 ;362:103-110
41. L Thines , Anévrismes artériels intracrâniens - Neurologie 17-490-B-10 ; Encyclopédie Médico-Chirurgicale, Paris, 2015
Messages
1. 3.1.1 Les anévrismes intracrâniens non rompus, 28 mars 2022, 11:55, par Francois Proust
A rajouter le papier de référence de l’équipe de Lariboisière sur une approche d’observation des anévrismes non rompus.
La série rétrospective de 661 anévrismes non rompus, suivi sur une durée moyenne de 51 mois, révélait une incidence de rupture de 0,1%, et une mortalité liée à d’autres causes de 0,8%. Validation de la stratégie de surveillance clinique et par imagerie. (Aubertin M, et al. J NeuroIntervent Surg 2021 ;0:1–6. doi:10.1136/neurintsurg-2021-018151)