#2. Métastases cérébrales
Alexandre ROUX, M.D., AP-HP, Hôpital St Anne, Philippe METELLUS, M.D., Ph.D., Clinique Clairval, Marseille, Johan PALLUD, M.D., Ph.D., AP-HP, Hôpital St Anne, mars 2022.
Questions - QCM
1. Concernant les métastases cérébrales, quelle(s) est/sont la/les réponse(s) exacte(s) ?
A. Les métastases cérébrales sont les tumeurs intracrâniennes les plus fréquentes.
B. Le mélanome est le principal pourvoyeur de métastases cérébrales.
C. L’origine ethnique est un prédicteur influençant la survenue d’une métastase cérébrale, indépendamment du primitif.
D. Le deuxième principal site anatomique touché par les métastases cérébrales est le cervelet qui représente 30-40% des localisations secondaires.
E. La répartition anatomique des métastases cérébrales varie selon l’origine histopathologique du cancer primitif.
2. Concernant les métastases cérébrales, quelle(s) est/sont la/les réponse(s) exacte(s) ?
A. Une métastase cérébrale peut être révélée par un ou plusieurs signe(s) de focalisation neurologique, une crise d’épilepsie ou des signes d’hypertension intracrânienne.
B. Un traitement par corticoïdes peut être prescrit afin de traiter la composante cytotoxique de l’œdème cérébral induit par une métastase.
C. Une prophylaxie anti-épileptique primaire doit systématiquement être réalisée chez un porteur d’une ou de plusieurs métastase(s) cérébrale(s).
D. Le traitement anti-épileptique de première intention le plus utilisé en France est le Levetiracetam.
E. Un dosage des différents marqueurs tumoraux doit être réalisé systématiquement lors du bilan de lésions secondaires cérébrales.
3. Concernant les métastases cérébrales, quelle(s) est/sont la/les réponse(s) exacte(s) ?
A. Le traitement focal de référence d’une métastase cérébrale est la chirurgie d’exérèse associée à une irradiation stéréotaxique du lit opératoire.
B. Il est possible d’envisager une chirurgie d’exérèse de métastase cérébrale à visée de réactualisation du statut histo-moléculaire.
C. Les prédicteurs d’un meilleur contrôle local d’une métastase cérébral sont le volume tumoral, l’étendue de la résection chirurgicale, l’exérèse monobloc sans morcellement et l’irradiation stéréotaxique post-opératoire du lit opératoire.
D. Les traitements systémiques médicaux n’agissent que sur le primitif systémique et/ou ses possibles métastases systémiques.
E. Une irradiation pan-encéphalique est le traitement de référence pour les patients poly-métastatiques cérébraux (> 4 métastases), indépendamment du primitif.
4. Concernant les métastases cérébrales, quelle(s) est/sont la/les facteur(s) pronostique(s) impactant la survie globale ?
A. L’âge.
B. L’index de Karnofsky.
C. Le nombre de métastases cérébrales.
D. La présence de métastases extracrâniennes.
E. Le statut histo-moléculaire du primitif.
5. Concernant les métastases cérébrales, quelle(s) est/sont la/les réponse(s) exacte(s) ?
A. La chirurgie d’exérèse d’une métastase d’un cancer bronchique à petites cellules est rare devant une bonne efficacité de l’irradiation cérébrale associée aux chimiothérapies.
B. La mutation de l’EGFR, le réarrangement d’ALK et la mutation BRAF sont les principales mutations permettant l’introduction d’une thérapie ciblée dans le cancer broncho-pulmonaire non-à petites cellules.
C. Le sous-type histologique le plus défavorable dans le cancer du sein est le phénotype Triple Négatif (Basal ou RE-/RP-, HER2-)
D. La mutation BRAF est le principal facteur pronostic moléculaire dans le mélanome.
E. L’Index GPA permet d’estimer la survie des patients porteurs de métastase(s) cérébrale(s).
1/ Généralités
a/ Epidémiologie
Les métastases cérébrales sont les tumeurs intracrâniennes les plus fréquentes chez l’adulte[1]. L’incidence exacte des métastases cérébrales varie entre 5 à 40% (réf.5) des patients porteurs d’un cancer au stade métastatique[1–4] Les cancers du poumon et du sein sont les principaux pourvoyeurs de métastases cérébrales[5]. L’histopathologie du cancer primitif et l’extension tumorale du cancer primitif sont les principaux facteurs influençant l’épidémiologie des métastases cérébrales[4]. A contrario, le sexe et l’origine ethnique ne semblent pas influencer la survenue d’une métastase cérébrale[1,3].
b/ Topographie
Les métastases cérébrales survenant par voie hématogène, leur répartition topographique est liée au volume des structures anatomiques cérébrales[5] :
- Hémisphérique supra-tentorielle : 70-80% ;
- Cérébelleuse : 15-25% ;
- Tronc cérébral : 5%.
Cette répartition topographique est variable selon l’histopathologie du cancer primitif (réf.6) et (réf.7)
c/ Terminologie
En pratique clinique, une métastase cérébrale peut être découverte dans trois situations chronologiques bien distinctes :
1. Prévalente : alors que la néoplasie primitive n’est pas encore connue ;
2. Synchrone : découverte lors du bilan d’extension initial de la néoplasie primitive ;
3. Métachrone ou tardive : alors que la néoplasie primitive est déjà connue.
d/ Bilan clinique
L’interrogatoire du patient doit s’attarder à rechercher des facteurs de risques de cancer (tabagisme, consommation d’alcool ou d’autres toxiques, sédentarité, exposition solaire, etc…), de profession à risque (exposition à l’amiante, etc…), d’antécédents personnels ou familiaux de cancer ou d’autres pathologies pouvant favoriser la survenue d’un cancer (réf.8 et 9).
L’examen clinique doit comprendre un examen somatique complet incluant la palpation des organes à risque de cancer, la recherche d’adénopathies et la recherche d’une altération de l’état général (asthénie, anorexie, amaigrissement). Il sera important d’insister sur la recherche de troubles cognitifs, de signes de focalisation neurologique, d’atteinte des paires crâniennes, de signes d’hypertension intracrânienne et des arguments pour des crises d’épilepsie récentes.
La symptomatologie clinique associée aux métastases cérébrales n’est pas spécifique mais va dépendre de plusieurs facteurs : 1/topographie ; 2/nombre de métastases ; 3/volume des métastases ; 4/ importance de l’œdème vasogénique péri-tumoral ; 5/ présence d’une hydrocéphalie obstructive associée ; 6/ caractère hémorragique.
d/ Bilan paraclinique
L’examen de référence pour le bilan de métastases cérébrales est l’IRM cérébrale avec injection. Elle devra être systématiquement réalisée avant toute procédure thérapeutique si l’état du patient et son terrain le permet (réf.10). L’avantage de l’IRM sur le scanner cérébral est une meilleure détection des métastases, une meilleure caractérisation des rapports anatomiques des métastases ainsi que du du statut mono-métastatique, oligo-métastatique (3 métastases et moins) ou poly-métastatique (4 métastases et plus) du patient[6–9].
Un bilan extra-crânien par scanner thoraco-abdomino-pelvien et Body-PET-scan devra également être réalisé pour dépister l’origine du primitif ou, si celui-ci est connu, son extension locale, ganglionnaire et métastatique systémique (pulmonaire, hépatique, osseux, …). Il permettra également de discerner une métastase cérébrale solitaire (sans autre métastase retrouvée) d’une métastase cérébrale unique (une seule métastase cérébrale mais présence d’autre(s) métastase(s) extra-cérébrale(s)). Il permettra également de statuer sur le statut du cancer primitif et son caractère contrôlé / contrôlable ou polymétastatique / en échappement.
Un bilan sanguin complet incluant : NFS, ionogramme sanguin, urée, créatinine, bilan hépatique complet, exploration d’une anomalie lipidique, albumine, pré-albumine, calcémie corrigée, hémostase complète.
Une IRM pan-médullaire et une ponction lombaire peuvent être réalisée en cas de point d’appels cliniques et radiologiques de méningite carcinomateuse. Elles ne sont pas réalisées à titre systématique. La ponction lombaire ne doit pas être réalisée en cas de métastases à risque d’engagement et/ou en cas de signes cliniques d’hypertension intracrânienne.
Un marqueur tumoral peut être dosé si le primitif est connu. Il ne doit pas être réalisé à visée diagnostique.
e/ Thérapeutique médicale
En présence d’une ou de plusieurs métastases cérébrales œdémateuse(s) et/ou symptomatique(s), il est recommandé d’introduire un traitement par corticoïdes (voie parentérale ou entérale selon l’état clinique du patient). La posologie est comprise entre 1 à 2mg/kg/j et doit être suivie d’une décroissance progressive adaptée à l’état d’avancement des thérapeutiques oncologiques et de la tolérance clinique du patient.
Il n’est pas recommandé d’introduire une prophylaxie anti-épileptique primaire[10]. Par contre, l’existence ou la suspicion de crises d’épilepsie chez un patient porteur d’une métastase cérébrale justifie l’introduction d’un traitement anti-épileptique. En France, le Levetiracetam ou le Lacosamide sont les traitements de première intention. La posologie de ces traitements doit être adaptée au contrôle épileptique qui, s’il n’est pas obtenu, justifie l’avis d’un épileptologue.
f/ Thérapeutique oncologique
La décision du traitement oncologique doit être, si possible, discutée en RCP dédiée lorsque l’état clinique du patient le permet (réf.11). Les deux principaux traitements focaux des métastases cérébrales étant la chirurgie d’exérèse et la radiothérapie, un neurochirurgien doit être systématiquement présent pour valider l’indication chirurgicale ou l’indication de radiothérapie (réf.12). Du fait d’une grande chimio- ou radiosensibilité, certains types histologiques tels que les carcinomes bronchiques à petites cellules ou les métastases de tumeurs germinales ne sont généralement pas chirurgicaux.
Un traitement focal des lésions cérébrales est indiqué chez un patient en bon état général (IK > 60) avec 1 à 3 métastases cérébrales (statut oligo-métastatique) et un cancer primitif contrôlé ou contrôlable. La séquence thérapeutique de référence est la chirurgie d’exérèse d’une/des lésion(s) symptomatique(s), suivie d’une radiothérapie du lit opératoire en conditions stéréotaxiques[11,12]. En cas de lésion(s) inaccessible(s) à la chirurgie ou de lésion(s) de petite(s) taille(s), un traitement par irradiation stéréotaxique seul peut être réalisé ou un traitement systémique seul peut être réalisé selon les données de la documentation biologique (réf.13).
Chez le patient avec 4 métastases cérébrales ou plus (statut poly-métastatique), il peut être discuté un traitement par irradiation stéréotaxique des lésions ou une irradiation pan-encéphalique (EIT pour encéphale in toto) selon le nombre, le volume des lésions, ou son état général[13]. En effet, si le patient à une perte d’autonomie franche (IK<60) et/ou un échappement au traitement de son cancer, il peut se discuter alors de réaliser un EIT ou d’opter pour les soins palliatifs.
De plus, il peut parfois être discuté une chirurgie d’exérèse de métastase cérébrale dite « non chirurgicale » à visée de documentation histo-moléculaire afin de pouvoir identifier certaines mutations génétiques pouvant impacter le traitement oncologique adjuvant 14 ou en cas d’une lésion particulièrement symptomatique. Enfin, il peut être discuté une chirurgie d’exérèse d’une métastase cérébrale de fosse postérieure, en raison du risque de décompensation clinique ultérieure, même quand elle est asymptomatique et/ou dans un contexte poly-métastatique[5].
Dans tous les cas, le Neurochirurgien doit avoir en tête les 3 principaux objectifs d’une chirurgie de résection de métastase cérébrale :
1) Diagnostique : identifier une néoplasie sous-jacente non connue, non accessible ou non détectable ; intérêt d’une réactualisation histo-moléculaire pouvant modifier la prise en charge oncologique médicale ;
2) Symptomatique : améliorer la fonction neurologique, réduire des symptômes d’hypertension intracrânienne ou encore améliorer le contrôle épileptique du patient. Enfin, la chirurgie d’exérèse peut aussi être réalisée en prévention d’une symptomatologie à venir (risque d’hydrocéphalie obstructive par exemple) ;
3) Oncologique : à adapter selon le caractère mono-, oligo- ou polymétastatique du patient. Le bénéfice du contrôle local de la ou les lésion(s) opérée(s) doit se répercuter sur la survie globale du patient. (réf.14, 15 et 16)
Lorsque qu’on envisage une chirurgie d’exérèse d’une métastase cérébrale, il faut systématiquement tenir compte de la balance onco-fonctionnelle pour un patient donné et ainsi pouvoir être en mesure d’assurer une préservation de l’état fonctionnel du patient[14]. Ceci implique que le neurochirurgien doit pouvoir réaliser cette chirurgie d’exérèse en condition éveillée avec une cartographie fonctionnellle cortico-sous-corticale per-opératoire lorsqu’il le juge nécessaire. En effet, une dégradation neurologique post-opératoire pourrait conduire à une perte d’indépendance fonctionnelle et ainsi modifier la stratégie oncologique médicale adjuvante et aboutir à une perte de chance pour le patient.
Il convient de noter qu’une étude à faible niveau de preuve a suggéré que le contrôle local des métastases cérébrales semblait meilleur en cas d’exérèse « monocloc » que « pluri-fragmentée »[15] car elle réduit le risque de dissémination de cellules tumorales au cours de la chirurgie. Cette notion, qui doit être connue du neurochirurgien, mérite d’être étayée par des études supplémentaires.
Un traitement oncologique médical doit systématiquement être discuté de façon adjuvante au traitement focal afin de pouvoir, si possible, agir sur l’extension systémique de la maladie et/ou cérébrale de façon complémentaire. Ce traitement peut inclure un protocole de chimiothérapie, d’immunothérapie ou de thérapie ciblée. (réf.17)
g/ Facteurs pronostiques
Les facteurs influençant le contrôle local sont : volume tumoral, étendue de résection chirurgicale, irradiation stéréotaxique post-opératoire[11,12,16].
Les facteurs influençant la survie sont : âge, index de Karnofsky, nombre de métastases cérébrales, présence de métastases extracrâniennes, statut histo-moléculaire du primitif.
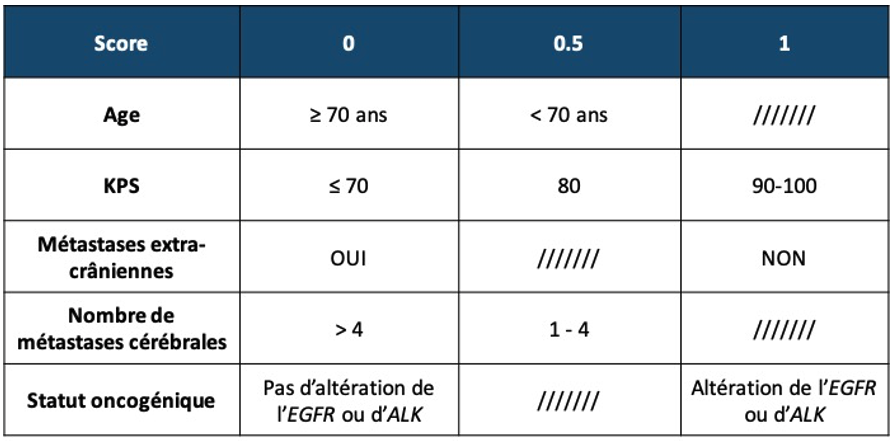
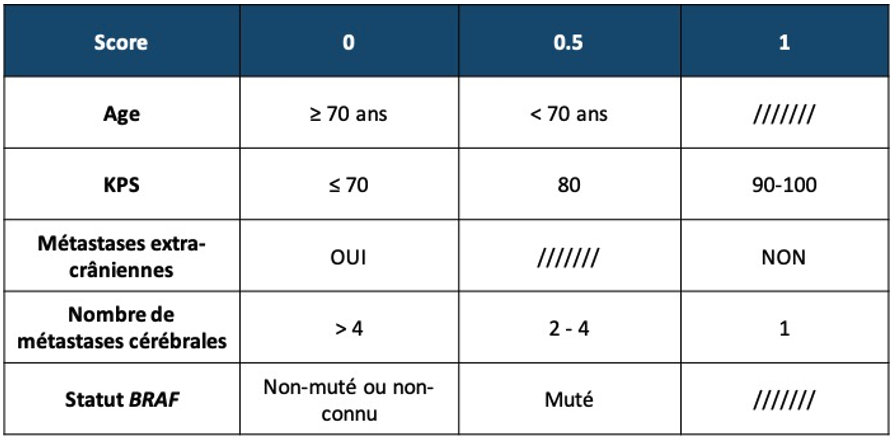
Le Score GPA (Graded Prognostic Assessment) permet une évaluation rapide du pronostic des patients et est une aide à la prise de décision https://brainmetgpa.com/[17]. Plus récemment, ces scores GPA, adaptés à chaque néoplasie, ont été actualisés avec l’intégration de données moléculaires influençant significativement le pronostic des patients atteint d’un cancer du poumon[18] ou d’un mélanome[19]. En effet, dans le cancer du poumon, la présence d’une mutation de l’EGFR ou un réarrangement d’ALK ressortent comme deux facteurs pronostiques favorables autorisant l’introduction de thérapie(s) ciblant ces mutations et agissant à la fois sur la néoplasie primitive, les métastases systémiques et cérébrales[18]. Pour les mélanomes, c’est la présence d’une mutation BRAF qui impacte positivement le pronostique et permettre, là encore, l’introduction de thérapie(s) ciblant cette mutation[19].
2/ Particularités des métastases des cancers pulmonaires
a/ Généralités
Les cancers broncho-pulmonaires sont les tumeurs solides les plus pourvoyeuses de métastases cérébrales. Sur le plan histopathologique, on retrouve principalement les cancers bronchiques non à petites cellules (CBNPC) et les cancers bronchiques à petites cellules (CBPC).
Au moins une métastase cérébrale est retrouvée chez 9 à 17% des patients porteurs d’un CBNPC lors de la prise en charge initiale de la maladie avec 40 à 50% de ces patients qui développeront une maladie métastatique cérébrale au cours du suivi[20]. Ces chiffres ont tendance à augmenter grâce à la meilleure détection et à la recherche plus systématique des métastases cérébrales lors du bilan initial de la maladie.
Concernant les CBNPC, on retrouve les métastases cérébrales plus fréquemment dans les adénocarcinomes que dans les cancers épidermoïdes. Dans les CBPC, elles surviennent dans 70 à 80% des cas au cours du suivi.
b/ Prise en charge thérapeutique
1. CBNPC
Le traitement focal de la ou des métastases cérébrales est à privilégier en premier lieu : chirurgie et/ou irradiation stéréotaxique.
Un traitement focal de la tumeur bronchique sera envisagé en RCP d’Oncologie Thoracique selon la topographie tumorale, l’extension locale et régionale (ganglionnaire), l’état général, le terrain et le statut métastatique systémique et cérébral. Il pourra ainsi être proposé une chirurgie d’exérèse de la tumeur pulmonaire ou une radio-chimiothérapie concomitante.
Un traitement systémique adjuvant sera réalisé selon les résultats histologiques, le statut moléculaire de la maladie (Score PD-L1, réarrangement ALK, mutation de l’EGFR) ainsi que le délai entre le traitement du cancer broncho-pulmonaire et la récidive cérébrale (si contexte métachrone). Il pourra être discuté un traitement par anti-PD1 (Nivolumab, Pembrolizumab, Atezolizumab), anti-EGFR (Osimertinib, Afatinib, Erlotinib, Géfitinib) ou anti-ALK (Alectinib, Ceritinib, Crizotinib, Brigatinib).
2. CBPC
Dans les rares cas de métastase unique prévalente, le traitement chirurgical est en règle générale réalisé en première intention et permet le diagnostic de CBPC à posteriori. Le plus souvent, il s’agit d’une rechute cérébrale seule après CBPC traité. Le traitement des métastases cérébrales à privilégier dans les CBPC reste l’irradiation pan-encéphalique, lorsque cela est possible. Si celle-ci a déjà été réalisée en prophylactique, il est alors recommandé de réaliser une irradiation stéréotaxique de la ou les lésion(s) évolutive(s) en tenant compte de l’irradiation préalable. (réf. 18)
Le traitement du primitif sera principalement systémique avec un protocole de chimiothérapie qui devra être décidé en RCP d’Oncologie Thoracique (Cisplatine-Etoposide ou Carboplatine-Etoposide par exemple +/- Atezolizumab). Son efficacité sur les métastases cérébrales est identique à celle sur les autres sites tumoraux ce qui explique le faible taux de résection chirurgicale pour cette maladie.
c/ Score pronostique : L’index Lung-molGPA
Ce score publié en 2017 [18] concerne uniquement les patients porteurs d’un CBNPC. La force de ce score est qu’il tient compte de la présence ou non d’une mutation de l’EGFR ou d’un réarrangement d’ALK, pouvant ainsi modifier la prise en charge thérapeutique oncologique médicale adjuvante (Figure 1).
3/ Particularités des métastases des cancers du sein
a/ Généralités
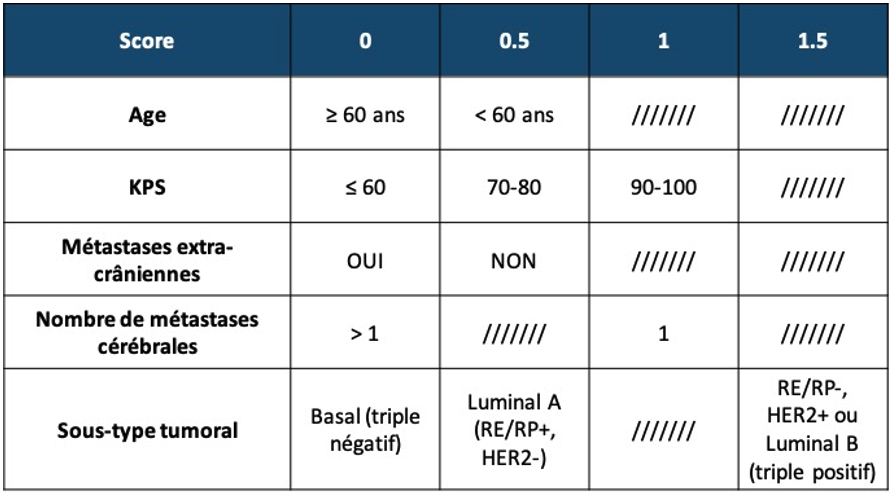
Dans le cancer du sein, l’incidence des métastases cérébrales varie entre 5 et 20%[21]. Le principal facteur influençant la survenue d’une métastase cérébrale est le sous-type histo-moléculaire avec une plus grande incidence dans les formes HER2+ et dans les cancers « triple négatifs » (RP-, RE- et HER2-)[22].
b/ Prise en charge thérapeutique
Le traitement focal de la ou des métastase(s) cérébrale(s) est à privilégier en premier lieu : chirurgie et/ou irradiation stéréotaxique.
Un traitement focal de la tumeur mammaire sera envisagé en RCP d’Oncologie Sénologie selon l’extension locale et régionale (ganglionnaire), l’état général, le terrain et le statut métastatique systémique et cérébral. Il pourra ainsi être proposé une chirurgie d’exérèse de la tumeur mammaire (mastectomie partielle ou complète) +/- curage ganglionnaire et/ou une radiothérapie adjuvante. Indépendamment du traitement focal de la tumeur mammaire, il sera discuté la réalisation d’une chimiothérapie adjuvante +/- associée à un anti-HER2 (si muté) (Trastuzumab, Lapatinib, Pertuzumab, Afatinib, Nératinib) et une Hormonothérapie (si récepteurs hormonaux positifs) (Tamoxifène, Fulvestrant, Létrozole, Anastrozole, Exémestane).
c/ Score pronostique : L’index Breast-GPA
Ce score publié en 2013 [22] tient compte de plusieurs facteurs pronostiques connus dans le cancer du sein (Figure 2).
4/ Particularités des métastases des mélanomes
a/ Généralités
Dans le mélanome, l’incidence des métastases cérébrales au diagnostic est d’environ 25% avec une incidence pouvant atteindre les 75% au cours de l’histoire naturelle de la maladie.
b/ Prise en charge thérapeutique
Le traitement focal de la ou les métastase(s) cérébrale(s) est à privilégier en premier lieu : chirurgie et/ou irradiation stéréotaxique.
Un traitement focal de la tumeur cutanée sera envisagé en RCP Mélanome selon l’extension locale et régionale (ganglionnaire), l’état général, le terrain et le statut métastatique systémique et cérébral. Il n’est en général pas recommandé de réaliser une exérèse de la lésion primitive du mélanome en contexte métastatique. Il pourra cependant être proposé une chirurgie d’exérèse de la tumeur cutanée +/- curage ganglionnaire. Indépendamment du traitement focal de la tumeur cutanée, il sera discuté la réalisation d’un traitement anti-BRAF (si muté) (Vemurafenib ou Dabrafenib en association avec un anti-MEK (Cobimetinib, Trametinib)) ou un anti-CTLA4 (Ipilimumab) +/- un anti-PD1 (Pembrolizumab, Nivolumab).
c/ Score pronostique : L’index Melanoma-molGPA
Ce score publié en 2017 [19] tient compte de plusieurs facteurs pronostiques connus dans le mélanome y compris moléculaires (Figure 3).
Réponses aux Questions
QCM 1. Réponses : A, E
Le cancer du poumon et du sein sont les principaux pourvoyeurs de métastases cérébrales.
L’origine ethnique ne semble pas influencer la survenue d’une métastase cérébrale dans un contexte néoplasique.
Le deuxième principal site anatomique touché par les métastases cérébrales est le cervelet qui représente 15-25% des localisations secondaires.
QCM 2. Réponses : A, D
Un traitement par corticoïdes peut être prescrit afin de traiter la composante vasogénique de l’œdème cérébral.
Une prophylaxie anti-épileptique primaire n’est pas recommandée chez les patients porteurs d’une ou plusieurs métastase(s) cérébrale(s) en l’absence de survenue d’une crise d’épilepsie.
Un dosage des différents marqueurs tumoraux n’est pas systématique lors du bilan de lésions secondaires cérébrales.
QCM 3. Réponses : A, B, C
Les traitements systémiques médicaux agissent principalement sur le primitif systémique et/ou ses possibles métastases systémiques mais, selon la molécule utilisée, peut avoir une efficacité significative sur les métastases cérébrales.
L’irradiation pan-encéphalique et stéréotaxique sont les traitements de référence pour les patients poly-métastatiques cérébraux (> 4 métastases). Le choix de l’une ou l’autre des modalités va dépendre de l’histologie du primitif, du nombre de métastases cérébrales ainsi que de leurs volumes.
QCM 4. Réponses : A, B, C, D, E
QCM 5. Réponses : A, C, D, E
Commentaire : La mutation BRAF n’est pas retrouvée dans les CBNPC.
Points forts
La chirurgie d’exérèse d’une métastase cérébrale a sa place chez les patients porteurs d’une à 3 métastases, en bon état général, dont le cancer primitif est contrôlé ou contrôlable.
Le traitement de référence, qui permet le meilleur taux de contrôle local dans une métastase cérébrale, est l’association d’une chirurgie d’exérèse complète suivie d’une irradiation stéréotaxique du lit opératoire.
La chirurgie d’exérèse peut être effectuée sous le contrôle d’une cartographie fonctionnelle per-opératoire en condition éveillée en cas de risques fonctionnels prévisibles du fait d’une localisation en région cérébrale éloquente ou profonde.
Les patients atteints d’une métastase cérébrale doivent être discutés dans des RCP auxquels assistent les neurochirurgiens.
Le neurochirurgien doit être au fait de l’évolution des marqueurs histo-moléculaires, de leurs impacts pronostiques et des thérapeutiques oncologiques médicales adjuvantes pour asseoir sa place en RCP « Métastases cérébrales ».
Point faible
Le pronostic oncologique des patients porteurs de métastases cérébrales reste sombre.
Bibliographie
[1] Nayak L, Lee EQ, Wen PY. Epidemiology of brain metastases. Curr Oncol Rep 2012 ;14:48–54. https://doi.org/10.1007/s11912-011-0203-y.
[2] Schouten LJ, Rutten J, Huveneers HAM, Twijnstra A. Incidence of brain metastases in a cohort of patients with carcinoma of the breast, colon, kidney, and lung and melanoma. Cancer 2002 ;94:2698–705.
[3] Fox BD, Cheung VJ, Patel AJ, Suki D, Rao G. Epidemiology of metastatic brain tumors. Neurosurg Clin N Am 2011 ;22:1–6, v. https://doi.org/10.1016/j.nec.2010.08.007.
[4] Villano JL, Durbin EB, Normandeau C, Thakkar JP, Moirangthem V, Davis FG. Incidence of brain metastasis at initial presentation of lung cancer. Neuro-Oncol 2015 ;17:122–8. https://doi.org/10.1093/neuonc/nou099.
[5] Roux A, Botella C, Still M, Zanello M, Dhermain F, Metellus P, et al. Posterior Fossa Metastasis-Associated Obstructive Hydrocephalus in Adult Patients : Literature Review and Practical Considerations from the Neuro-Oncology Club of the French Society of Neurosurgery. World Neurosurg 2018 ;117:271–9. https://doi.org/10.1016/j.wneu.2018.06.084.
[6] Davis PC, Hudgins PA, Peterman SB, Hoffman JC. Diagnosis of cerebral metastases : double-dose delayed CT vs contrast-enhanced MR imaging. AJNR Am J Neuroradiol 1991 ;12:293–300.
[7] Schellinger PD, Meinck HM, Thron A. Diagnostic accuracy of MRI compared to CCT in patients with brain metastases. J Neurooncol 1999 ;44:275–81.
[8] Sze G, Milano E, Johnson C, Heier L. Detection of brain metastases : comparison of contrast-enhanced MR with unenhanced MR and enhanced CT. AJNR Am J Neuroradiol 1990 ;11:785–91.
[9] Yokoi K, Kamiya N, Matsuguma H, Machida S, Hirose T, Mori K, et al. Detection of brain metastasis in potentially operable non-small cell lung cancer : a comparison of CT and MRI. Chest 1999 ;115:714–9.
[10] Walbert T, Harrison RA, Schiff D, Avila EK, Chen M, Kandula P, et al. SNO and EANO practice guideline update : Anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Neuro-Oncol 2021 ;23:1835–44. https://doi.org/10.1093/neuonc/noab152.
[11] Brown PD, Ballman KV, Cerhan JH, Anderson SK, Carrero XW, Whitton AC, et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3) : a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol 2017 ;18:1049–60. https://doi.org/10.1016/S1470-2045(17)30441-2.
[12] Mahajan A, Ahmed S, McAleer MF, Weinberg JS, Li J, Brown P, et al. Post-operative stereotactic radiosurgery versus observation for completely resected brain metastases : a single-centre, randomised, controlled, phase 3 trial. Lancet Oncol 2017 ;18:1040–8. https://doi.org/10.1016/S1470-2045(17)30414-X.
[13] Hatiboglu MA, Akdur K, Sawaya R. Neurosurgical management of patients with brain metastasis. Neurosurg Rev 2020 ;43:483–95. https://doi.org/10.1007/s10143-018-1013-6.
[14] Pelletier J-B, Moiraghi A, Zanello M, Roux A, Peeters S, Trancart B, et al. Is function-based resection using intraoperative awake brain mapping feasible and safe for solitary brain metastases within eloquent areas ? Neurosurg Rev 2021 ;44:3399–410. https://doi.org/10.1007/s10143-021-01504-6.
[15] Patel AJ, Suki D, Hatiboglu MA, Abouassi H, Shi W, Wildrick DM, et al. Factors influencing the risk of local recurrence after resection of a single brain metastasis. J Neurosurg 2010 ;113:181–9. https://doi.org/10.3171/2009.11.JNS09659.
[16] Lee C-H, Kim DG, Kim JW, Han JH, Kim YH, Park C-K, et al. The role of surgical resection in the management of brain metastasis : a 17-year longitudinal study. Acta Neurochir (Wien) 2013 ;155:389–97. https://doi.org/10.1007/s00701-013-1619-y.
[17] Sperduto PW, Kased N, Roberge D, Xu Z, Shanley R, Luo X, et al. Summary report on the graded prognostic assessment : an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol Off J Am Soc Clin Oncol 2012 ;30:419–25. https://doi.org/10.1200/JCO.2011.38.0527.
[18] Sperduto PW, Yang TJ, Beal K, Pan H, Brown PD, Bangdiwala A, et al. Estimating Survival in Patients With Lung Cancer and Brain Metastases : An Update of the Graded Prognostic Assessment for Lung Cancer Using Molecular Markers (Lung-molGPA). JAMA Oncol 2017 ;3:827–31. https://doi.org/10.1001/jamaoncol.2016.3834.
[19] Sperduto PW, Jiang W, Brown PD, Braunstein S, Sneed P, Wattson DA, et al. Estimating Survival in Melanoma Patients With Brain Metastases : An Update of the Graded Prognostic Assessment for Melanoma Using Molecular Markers (Melanoma-molGPA). Int J Radiat Oncol Biol Phys 2017 ;99:812–6. https://doi.org/10.1016/j.ijrobp.2017.06.2454.
[20] Alexander BM, Brown PD, Ahluwalia MS, Aoyama H, Baumert BG, Chang SM, et al. Clinical trial design for local therapies for brain metastases : a guideline by the Response Assessment in Neuro-Oncology Brain Metastases working group. Lancet Oncol 2018 ;19:e33–42. https://doi.org/10.1016/S1470-2045(17)30692-7.
[21] Kennecke H, Yerushalmi R, Woods R, Cheang MCU, Voduc D, Speers CH, et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol Off J Am Soc Clin Oncol 2010 ;28:3271–7. https://doi.org/10.1200/JCO.2009.25.9820.
[22] Sperduto PW, Kased N, Roberge D, Chao ST, Shanley R, Luo X, et al. The effect of tumor subtype on the time from primary diagnosis to development of brain metastases and survival in patients with breast cancer. J Neurooncol 2013 ;112:467–72. https://doi.org/10.1007/s11060-013-1083-9.