#2.5 Les métastases médullaires
Julien ENGELHARDT, M.D., Ph.D., CHU Bordeaux, septembre 2022
Généralités
La définition des métastases médullaires varie selon les séries publiées. Fréquemment, elles sont définies par une localisation secondaire d’un cancer solide, mais dans certains cas les localisations secondaires des tumeurs primitives du système nerveux central (épendymomes, médulloblastomes, gliomes) y sont rajoutées. Sur le plan topographique, il existe deux types de lésions intra-durales rachidiennes : les lésions leptoméningées (anatomiquement extra-axiales, plus souvent associées à une dissémination carcinomateuse méningée) et les lésions purement intra-parenchymateuses médullaires. La définition la plus stricte est : localisation secondaire intra-parenchymateuse médullaire d’un cancer solide.
Sur le plan épidémiologique, les métastases médullaires sont rares, compliquant entre 2 et 6% des cancers, selon la définition choisie (1), ce qui est marginal par rapport aux métastases cérébrales (20 à 25% des cancers) et aux métastases rachidiennes osseuses et épidurales (à ce titre les métastases intradurales ne représentent que 3,5% des métastases rachidiennes) (2). L’âge moyen de survenue se situe entre 55 et 60 ans, et le sex ratio est légèrement déséquilibré vers les femmes1. Les primitifs en cause se retrouvent selon la même fréquence que pour les métastases cérébrales : 40 à 50% de cancers du poumon (dont une part importante de cancers à petites cellules), 19% de cancers du sein puis en troisième position vient le cancer du rein (8 à 10%) (1).
Le diagnostic est souvent métachrone (75 à 90% des cas), avec un délai très variable par rapport à la découverte du primitif (12 à 16 mois en moyenne) (1,3). Dans 20% des cas, on retrouve plus d’une métastase dans le cordon médullaire, dans 60% des cas l’IRM encéphalique objective d’autres localisations et dans 30 à 60% des cas d’autres métastases sont retrouvées en dehors du SNC (1,3). Enfin, une dissémination sous-arachnoïdienne pourrait être retrouvée jusque dans 18% cas4.
Diagnostic clinique
La clinique est celle d’une atteinte médullaire de topographie et de sévérité variables, sans syndrome rachidien. Dans 15% des cas, les lésions médullaires sont asymptomatiques. Au diagnostic, environ 60% des patients sont indépendants sur le plan fonctionnel, et moins de 15% présentent un déficit moteur sévère ou complet1. Les diagnostics différentiels à ce stade clinique sont toutes les autres causes de compression médullaire (tumorale bénigne, maligne, non tumorale) ou d’atteinte intra-médullaire non tumorale.
Diagnostic radiologique
Comme pour toute atteinte médullaire, l’IRM avec injection est le seul examen radiologique à réaliser en l’absence de contre-indication formelle. Typiquement, on retrouve une lésion intra-médullaire nodulaire prenant le contraste sur les séquences T1.
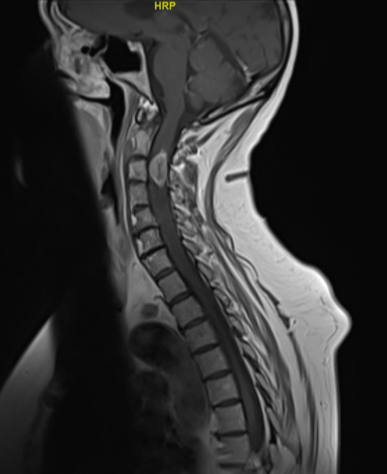
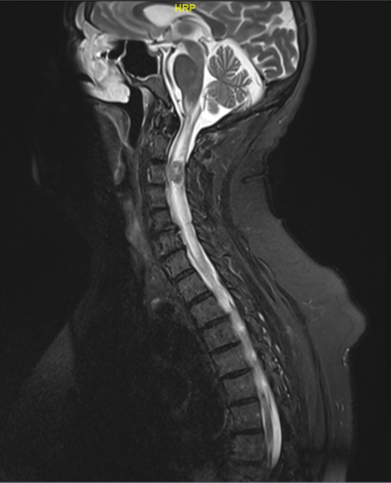
Sur les séquences sagittale T2, la lésion distincte du parenchyme médullaire est associée à un élargissement du calibre du cordon médullaire et un œdème péri lésionnel intramédullaire en général étendu (5).
Dans le cas de lésions volumineuses, la caractérisation topographique (épi ou intradurale) peut être plus difficile. Bien sûr, le diagnostic est orienté par le contexte (cancer connu ou non) et en l’absence de primitif identifié, le diagnostic peut être mis en défaut (cavernome en cas de lésion hémorragique, tumeur primitive du SNC, etc…). Enfin, dans de rares cas l’on peut observer d’autres types d’atteintes médullaires dans un contexte de cancer : myélite post-radique6 (délai médian de survenu après radiothérapie : 18 mois) ou myélopathie paranéoplasique7. Les images en IRM sont variables, mais une prise de contraste linéaire étendue sur plusieurs niveaux plutôt que nodulaire semble être la règle.
Traitements
Chirurgie
Techniquement, ces lésions peuvent s’opérer comme toute tumeur intra-médullaire, en suivant les mêmes règles opératoires. Les résultats fonctionnels post-opératoires semblent dépendre du degré de résection, du primitif en cause, de l’état neurologique préopératoire et de l’état général du patient5. Plusieurs séries de cas rétrospectives ont été rapportées dans la littérature, incluant au maximum 22 patients et sur des périodes de recueil s’étendant à deux décennies en moyenne (1,3,5,8–12). Globalement, le taux d’exérèse complète est autour de 80%. Sur le plan fonctionnel, on peut retenir que le taux d’aggravation (morbidité neurologique) est assez élevé, entre 15 et 31%, et qu’en moyenne 50% des patients vont voir leur déficit inchangé. Le taux de patients améliorés varie beaucoup entre les séries, entre deux extrêmes à 0 et 54% (10,12). Sur le plan oncologique, la chirurgie permet en contrôle local estimé à 77% pour une survie médiane entre 6,5 et 11,6 mois. A noter un risque de méningite carcinomateuse post-opératoire pouvant aller jusqu’à 23% (8). Au total, on retiendra que l’indication de choix se résume aux patients en bon état général, dont le primitif est contrôlé ou oligo-métastatique, présentant un déficit neurologique d’aggravation rapide8. Le cas des cancers radiosensibles (cancers pulmonaires à petites cellules par exemple) est peut-être une exception à cette indication.
Radiothérapie fractionnée
La radiothérapie fractionnée, à la dose de 20 à 30 Gy en 10 fractions en moyenne, est un des premiers traitements à avoir été administré dans le cade des métastases médullaires. Une série de 34 patients publiée en 199613 avait montré 31 stabilisations neurologiques, 3 améliorations et seulement une dégradation, mais pour une survie médiane de 4 mois. Cependant, ces résultats ne sont pas corroborés par une autre série de 12 patients parues en 2007 (11), dans laquelle la radiothérapie n’a permis de stopper la dégradation neurologique chez aucun patient.
Radiothérapie stéréotaxique
La première série publiée, en 2009, était assez encourageante (14). 9 patients traités par le système LINAC à la dose moyenne de 14 Gy en une fraction avec 80% d’amélioration neurologique, 10% de stabilisation et seulement 10% de dégradation ; pour un contrôle local complet de 22% et seulement 11% de progression radiologique sur un suivi médian de 10 mois. Depuis, ces résultats ont été consolidés par au moins 9 séries rétrospectives (33 patients maximum), utilisant essentiellement le Cyberknife. Le régime varie de la dose unique (jusqu’à 17 Gy) à l’hypofractionné (20 à 30 Gy en 3 à 6 fractions). La série française du centre Oscar Lambret à Lille, rapporte 40% d’amélioration neurologique et 60% de stabilisation, aucune toxicité et aucune progression radiologique sur un suivi médian de 23 mois (15).
Traitements systémiques
Aucun traitement systémique n’a montré d’efficacité sur les métastases intra-médullaires. A noter un cas publié d’une régression d’une lésion sous Nivolumab dans le cadre d’un cancer pulmonaire non à petites cellules (16).
Attitude thérapeutique en pratique
A la vue des données récentes de la littérature, les deux options thérapeutiques aboutissant à des résultats fonctionnels et oncologique (contrôle local) intéressants sont la chirurgie et la radiothérapie en conditions stéréotaxiques. La chirurgie est sûrement l’option à privilégier en cas de déficit d’aggravation rapidement progressive, mais son indication en première intention en cas de déficit léger à modéré, peu évolutif, est à contrebalancer avec le risque non négligeable d’aggravation post-opératoire et le pronostic de ce type de maladie. La radiothérapie stéréotaxique est un outil ayant montré des résultats fonctionnels dans le même ordre de grandeur que les séries chirurgicales, avec une morbidité neurologique à court terme inférieure à la chirurgie et un contrôle tumoral satisfaisant. Il s’agit probablement de l’option de choix pour la majorité des métastases intramédullaires. Dans le cas particulier d’un déficit neurologique sévère ou complet (15% des patients), le pronostic de récupération étant sombre, la radiothérapie stéréotaxique paraît être une bonne option dans l’optique du contrôle tumoral.
Références
1. Goyal, A. et al. Intramedullary spinal cord metastases : an institutional review of survival and outcomes. J. Neurooncol. 142, 347–354 (2019).
2. Fridley, J. S., Syed, S., Niu, T., Leary, O. P. & Gokaslan, Z. L. Presentation of spinal cord and column tumors. Neuro-Oncol. Pract. 7, i18–i24 (2020).
3. Sung, W.-S. et al. Intramedullary spinal cord metastases : a 20-year institutional experience with a comprehensive literature review. World Neurosurg. 79, 576–584 (2013).
4. Grem, J. L., Burgess, J. & Trump, D. L. Clinical features and natural history of intramedullary spinal cord metastasis. Cancer 56, 2305–2314 (1985).
5. Payer, S., Mende, K. C., Westphal, M. & Eicker, S. O. Intramedullary spinal cord metastases : an increasingly common diagnosis. Neurosurg. Focus 39, E15 (2015).
6. Khan, M. et al. Radiation-Induced Myelitis : Initial and Follow-Up MRI and Clinical Features in Patients at a Single Tertiary Care Institution during 20 Years. AJNR Am. J. Neuroradiol. 39, 1576–1581 (2018).
7. Flanagan, E. P. et al. Paraneoplastic isolated myelopathy : clinical course and neuroimaging clues. Neurology 76, 2089–2095 (2011).
8. Strickland, B. A., McCutcheon, I. E., Chakrabarti, I., Rhines, L. D. & Weinberg, J. S. The surgical treatment of metastatic spine tumors within the intramedullary compartment. J. Neurosurg. Spine 28, 79–87 (2018).
9. Hoover, J. M., Krauss, W. E. & Lanzino, G. Intradural spinal metastases : a surgical series of 15 patients. Acta Neurochir. (Wien) 154, 871–877 ; discussion 877 (2012).
10. Dam-Hieu, P. et al. Retrospective study of 19 patients with intramedullary spinal cord metastasis. Clin. Neurol. Neurosurg. 111, 10–17 (2009).
11. Lee, S. S. et al. Intramedullary spinal cord metastases : a single-institution experience. J. Neurooncol. 84, 85–89 (2007).
12. Gasser, T. et al. Surgical treatment of intramedullary spinal cord metastases of systemic cancer : functional outcome and prognosis. J. Neurooncol. 73, 163–168 (2005).
13. Schiff, D. & O’Neill, B. P. Intramedullary spinal cord metastases : clinical features and treatment outcome. Neurology 47, 906–912 (1996).
14. Shin, D. A., Huh, R., Chung, S. S., Rock, J. & Ryu, S. Stereotactic spine radiosurgery for intradural and intramedullary metastasis. Neurosurg. Focus 27, E10 (2009).
15. Tonneau, M., Mouttet-Audouard, R., Le Tinier, F., Mirabel, X. & Pasquier, D. Stereotactic body radiotherapy for intramedullary metastases : a retrospective series at the Oscar Lambret center and a systematic review. BMC Cancer 21, 1168 (2021).
16. Phillips, K. A., Gaughan, E., Gru, A. & Schiff, D. Regression of an intramedullary spinal cord metastasis with a checkpoint inhibitor : a case report. CNS Oncol. 6, 275–280 (2017).