Figure 1
#3.5 Hypotension intracrânienne
Baptiste BOUCHIER, M.D., Service d’Anesthésie-Réanimation, François PROUST, M.D., Ph.D., Service de Neurochirurgie, CHRU Strasbourg, janvier 2023
Questions
1. Quel est l’incidence de l’hypotension intracrânienne spontanée :
A. 0.2 / 100 000 / an
B. 36 / 100 000 / an
C. 5 / 100 000 / an
D. 20 / 100 000 / an
E. 0.01 / 100 000 / an
2. L’hypotension intracrânienne spontanée est définie par :
A. Une pression intracrânienne inférieure à 6 cm H2O
B. Une fuite liquidienne au niveau de la base du crâne
C. 3 types de fistule peuvent en être responsable
D. Une fuite liquidienne au niveau rachidien
E. L’existence de troubles cochléo-vestibulaires
3. Les examens complémentaires à programmer face à une hypotension intracrânienne spontanée sont :
A. Une TDM crânio-encéphalique en fenêtre osseuse en coupes coronales
B. Un PET scanner
C. Une IRM crânio-encéphalique
D. Un myéloscanner dynamique rachidien
E. Des potentiels évoqués auditifs
4. L’hypotension intracrânienne secondaire peut être due à :
A. Une implantation de neuromodulation
B. Une anesthésie péridurale
C. Un méningocèle post-opératoire
D. Une fistule de type 3
E. Une infiltration articulaire
5. Le syndrome de tréphine se caractérise par :
A. Une hypoperfusion corticale
B. Une pression atmosphérique responsable de la rupture de microgravité endocrânienne
C. Un traitement par la position déclive
D. Un risque de souffrance du mésencéphale
E. Un trouble du retour veineux
Memento didactique
L’hypotension intracrânienne est définie par une baisse de la pression d’ouverture à la ponction lombaire inférieure à 6 cm d’H20 (1). L’étiologie peut en être iatrogène lors de ponction lombaire ou de craniectomie décompressive, traumatique crânio-vertébrale ou spontanée.
L’encéphale est immergé dans un espace liquidien de liquide cérébro-spinal (LCS) délimité par les enveloppes de la boite crânienne. Cet environnement purement liquidien détermine un état de « microgravité » dont témoigne les différences de poids moyen de l’encéphale selon son immersion ou non, respectivement calculé à 50 g et 1400 g (2). Les différents systèmes d’homéostasie cérébrale (pression de perfusion, barrière hémato-encéphalique, autorégulation cérébrale) sont optimisés dans cette situation de microgravité mais restent fonctionnels lorsque l’encéphale est l’objet de la gravité terrestre par exemple lors de craniotomie.
Elle est responsable de syndromes cliniques divers, allant de la céphalée orthostatique du syndrome d’hypotension intracrânienne spontané (HIS) observé en consultation jusqu’au coma secondaire au « syndrome de tréphine » en milieu de réanimation neurochirurgical. Leur pathogénie en est très différente.
Hypotension intracrânienne spontanée (HIS)
Le terme d’hypotension intracrânienne spontanée (HIS) s’applique aux hypotensions secondaires à une fuite liquidienne au niveau du canal rachidien (3). Cette fuite de LCS peut se produire dans l’espace extra-durale par effraction durale due à une lésion dégénérative de l’étui disco-vertébral (spicules osseuses, hernie discale) ou kyste dural spinal. Outre la céphalée orthostatique, l’expression neurologique en est extrêmement diverse.
L’HIS a une incidence de 5/100 000/an. Considéré à tort chez 94% des patients comme une migraine, une altération psychologique, les séquelles d’une méningite voire une simulation, ces patients sont exposés à une errance ou un nomadisme médical.
Physiopathologie
Le facteur pathogénique est la fuite de liquide cérébro-spinale (LCS) au niveau du canal rachidien en position orthostatique. Elle détermine des déséquilibres hydrodynamiques péri-encéphaliques et hémodynamiques hypothalamo-hypophysaires :
Un gradient de pression positif épidural – intradural source de traction des fibres sensitives durales responsable de la céphalée orthostatique.
Une perte de flottabilité de l’encéphale et des paires crâniennes responsable de désorganisation anatomique et hémodynamique. Le LCS, en condition physiologique, maintient l’encéphale en suspension dans l’espace clos que constitue la boite crânienne. La fuite de LCS soumet l’encéphale à l’action de la gravité et induit son déplacement vers le bas associé à une traction inhérente des paires crâniennes fixées par leurs orifices de perforation de la base du crâne.
Une perturbation cochléo-vestibulaire par hypotension de la périlymphe conduisant à un hydrops endolymphatique et la maladie de Ménière
Les perturbations hémodynamiques hypothalamo-hypophysaires concernent le système veineux porte induisant une hyperhémie pituitaire symptomatique sous forme d’hyperprolactinémie, et d’autres désordres endocriniens.
Les perturbations hémodynamiques parenchymateuses par stagnation veineuse,
Les conséquences structurelles peuvent être sévères :
Dissection des veines en pont para-sagittales de la convexité responsable d’hématome sous-dural bilatéraux ou d’hémosidérose superficielle.
Engagement rostro-caudal au niveau du foramen de Pacchioni détermine une souffrance du diencéphale et mésencéphale, une occlusion veineuse des sinus profonds, une contrainte mécanique sur les faisceaux de substances blanches, les noyaux gris profonds, le cervelet.
Déplacement du cordon médullaire vers le site de la fuite déterminant une hernie médullaire transdurale.
Présentation clinique
Le syndrome d’HIS peut survenir à tout âge (2-88 ans) avec une prédominance féminine (63%). La céphalée, classiquement positionnelle ou orthostatique, est le symptôme le plus fréquent (97% des patients). Ses caractères sémiologiques varient avec le temps, elles deviennent non-orthostatiques, en lien avec l’effort, parfois liée à la toux, de seconde moitié de journée. Ainsi une céphalée chronique non expliquée doit être investiguée comme un symptôme potentiel d’un HIS.
La topographie est diffuse ou polaire sur les régions occipitales ou frontales. Les signes associés par ordre décroissant de fréquence sont : les nausées, les cervicalgies, les raideurs cervicales, acouphènes, vertiges, altération de l’audition, diplopie, altération cognitive.
La combinaison d’une altération comportementale sociale ou sexuelle, d’une désorganisation exécutive, de l’existence de stéréotypie, peu évoquer une démence fronto-temporale. Mais l’association à des signes cérébelleux, des signes du tronc cérébral, une céphalée doit faire suspecter une HIS, et la distinguer d’une pathologie dégénérative lobaire fronto-temporale. Le traitement de la fistule liquidienne en permet la résolution complète chez 67% des patients (4).
Les altérations génétiques du tissu conjonctif tel que syndrome de Marfan ou d’Elher-Danlos, par la fragilité structurelle durale, expose les patients à la survenue spontanée de ces brèches durales.
Examens complémentaires
Diagnostic positif d’hypotension intracrânienne
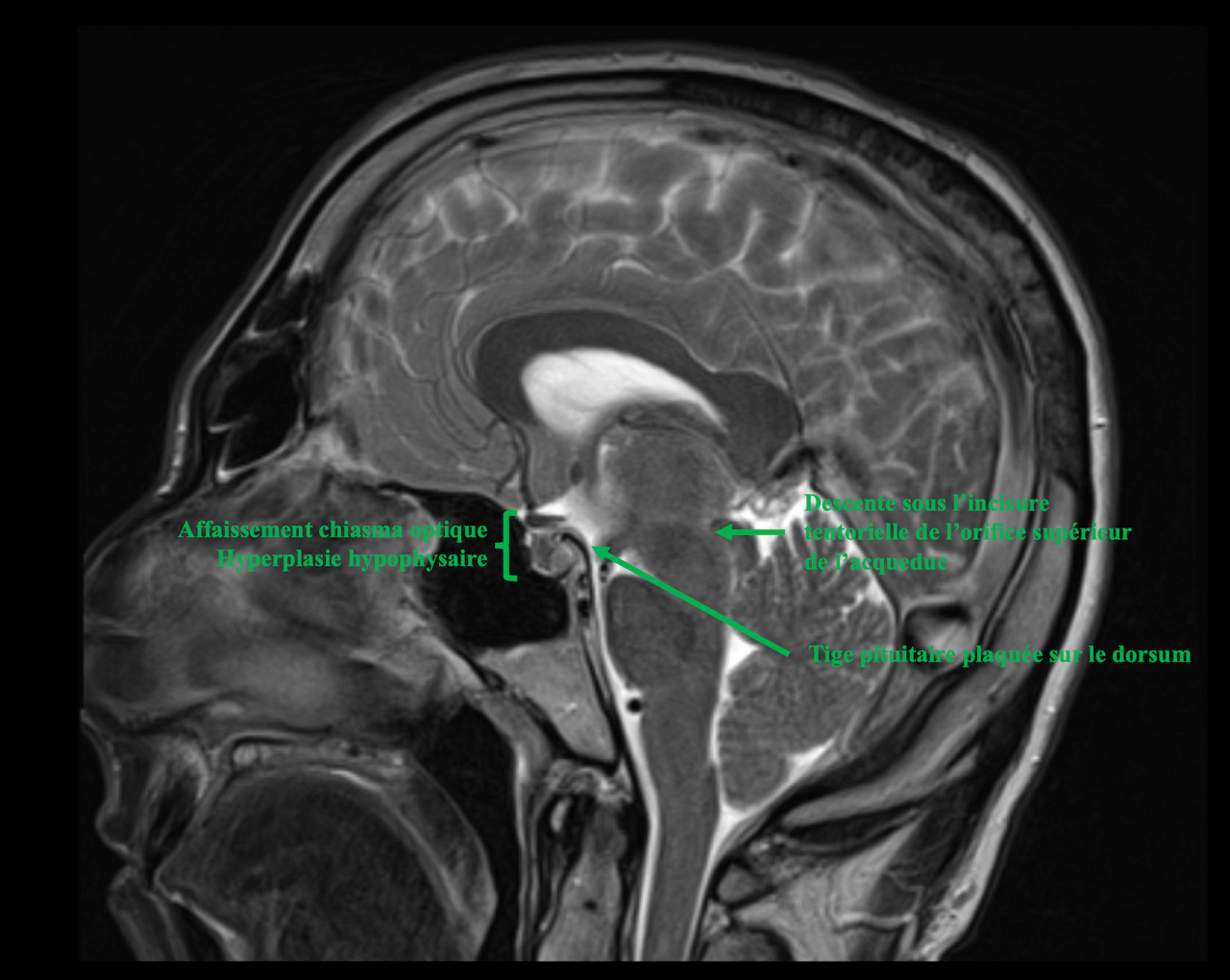
L’imagerie en résonnance magnétique nucléaire (IRM) cérébrale révèle les anomalies typiques au nombre de 4 : les collections liquidiennes sous-durales, l’engorgement des structures veineuses, le rehaussement des méninges à l’injection de gadolinium et le déplacement du parenchyme cérébral vers le bas (5). Non pathognomoniques, ces signes constituent un faisceau d’argument.
Un score (0-9, du peu au hautement probable) peut être établi à partir de signes majeurs coté 2 points (rehaussement méningé, engorgement des sinus veineux, effacement de la citerne supra-sellaire) et mineurs coté 1 point (collections sous-durales, effacement de la citerne prépontique, et réduction de la distance mamillo-pontique (≤ 5 mm) (6).
Figure 1. L’IRM sagittale sur la ligne médiane en séquence T1 sans injection révèlait l’affaissement du chiasma optique sur une hyperplasie hypophysaire, l’effacement des citernes périchiasmatiques, la descente sous l’incisure tentorielle de l’orifice supérieur de l’acqueduc.
Plusieurs circonstances ouvrent la discussion (7) :
La descente des amygdales cérébelleuses peut évoquer l’anomalie jonctionnel de Chiari de type I liée à une dystrophie des enveloppes de la fosse postérieures mais les signes de déplacement de l’encéphale sont associés.
L’épaississement méningé peut mimer une pachyméningite de maladie liée à l’immunoglobuline 4, de neurosarcoïdose, d’arthrite rhumatoïde, de maladie de Rosay-Dorfman, maladie d’Erhdheim-Chester, d’infections (tuberculose, Syphilis, Lyme, Cryptococcus).
L’hémosidérose focale peut être liée à la dissection des veines en pont ou la brèche durale.
Diagnostic de fistule durale liquidienne rachidienne
Les fistules de LCS peuvent être de plusieurs natures : type 1 (ouverture durale antérieure ostéogénique) ou de type 2 (gaine durale radiculaire) ou de type 3 (espace intrathécale vers les veines épidurales). Dans ce dernier type, la fuite est associé chez 82% des patients à un diverticule radiculaire.
L’IRM vertébro-médullaire doit explorer l’ensemble du rachis en utilisant des séquences T2 hautes résolutions, et des séquences 3D. La présence ou non d’une collection liquidienne extradurale longitudinale détermine la chronologie des examens complémentaires futures. Sa présence témoigne d’une fistule liquidienne de type 1 ou 2.
L’existence d’une fuite liquidienne est argumentée par une basse résistance à l’injection intrathécale de sérum physiologique par ponction lombaire : une Rcsf < 5 mm Hg / mL a une sensibilité et spécificité diagnostique de 80%.
La réalisation d’une myélographie, que ce soit une myélographie dynamique conventionnelle, une myélographie digitale en soustraction, ou mieux un myéloscanner dynamique permet d’identifier le site de la fistule après injection intrathécale de produit de contraste iodé combiné à une position adaptée du patient : position ventrale pour les fistules de type 1, latérale pour les fistules de type 2. Le scanner post-myélographie permet de déterminer les causes disco-vertébrales et parfois d’identifier le niveau de la fuite.
Pour identifier les fistules de type 3, la myélographie digitale de soustraction est l’examen dédié. L’acquisition des images durant l’inspiration en augmente leur visibilité.
L’injection intrathécale de gadolinium suivie d’une IRM est une méthode en cours d’exploration.
Hypotension intracrânienne rachidienne secondaire
Par définition le syndrome HIS est à distinguer des formes secondaires malgré une similitude clinique. Ces formes secondaires sont des brèches iatrogènes lors de geste percutanés rachidiens dans l’espace épidurale (péridurale, implantation épidurale d’électrodes pour neuromodulation ou de cathéter pour site d’accès pour douleur chronique), dans l’espace intradurale (ponction lombaire, anesthésie intradurale), lors de traitement chirurgical rachidien responsable de la création de méningocèle spinal.
L’expression clinique dépens du débit de la fistule. Mais la céphalée a tendance à se chroniciser sans lien avec l’orthostatisme. Les signes associés peuvent être tenus.
Les traitements sont adaptés à l’étiologie.
Hypotension intracrânienne crânio-encéphalique
Les causes crânio-encéphaliques sont scindées selon 2 mécanismes, soit une fuite de LCS, soit un défect de la voute osseuse crânienne.
Par fuite de liquide cérébrospinale
La fuite de LCS détermine une baisse de pression intracrânienne source de distension durale, support morphologique de la céphalée. Mais les conséquences décrites plus haut dépendent du siège de la fistule durale. `
Les causes sont des fistules de la base du crâne ou des drainages de dérivation interne. Leurs décompensations cliniques déterminent des céphalées chroniques parfois orthostatiques, holoencéphalqiues, intermittentes et quelques signes associés à type de nausées. Leur caractère inhabituel nous oriente.
Les conséquences morphologiques, limitées à l’espace supra-tentoriel, sont un décollement péricérébral avec mise en tension des veines en pont, source potentielle d’hématome sous-dural chronique par dissection lors d’ébranlement traumatique. Aucune anomalie diencéphalique ou du tronc cérébral ne sont observées, même lors de fistule de la base de crâne basse comme la topographie mastoïdienne.
Secondaire à une crâniectomie ou « sinking flap syndrome »
Le mécanisme de l’hypotension intracrânienne est mal élucidé et différents mécanismes (8, 9) sont liés au défect de voute :
La pression atmosphérique, en s’appliquant dans l’enceinte crânio-encéphalique, rompt l’atmosphère de microgravité physiologique intracrânienne et détermine des perturbations hydrodynamiques et circulatoires.
La circulation hydrodynamique en regard du défect osseux est altérée par les adhérences cicatricielles de l’espace sous-arachnoïdien sources de cloisonnement. Mais aussi, la diminution de l’effet systolo-diastolique induit une réduction de la circulation liquidienne. Enfin, les conséquences de circulation du système glymphatique sont probables.
L’altération du flux sanguin cortical, illustrée par les études de débit au Xenon, serait secondaire à l’effet de la pression atmosphérique sur la circulation veineuse. La conséquence en est une déficience du métabolisme du glucose.
La présentation clinique est pauvrement décrite, hormis l’invagination du revêtement du scalp dans le défect osseux témoignant du déplacement de la masse encéphalique. La faiblesse motrice est le symptôme le plus fréquent, suivi de l’altération cognitive (8). La céphalée est peu rapportée (19%). Cependant, chez les patients autonomes, cette céphalée orthostatique est un argument de plastie crânienne. Enfin, des formes sévères de coma sont rapportés chez 15% des patients (9, 10).
Les facteurs de décompensation (9) sont : les drainages qu’ils soient rachidiens par ponction lombaire ou les drainages ventriculaires internes mais aussi la position assise. L’amélioration des patients est notée lors de positionnement déclive ou en décubitus strict.
Points forts
La céphalée orthostatique est le symptôme dominant de l’hypotension intracrânienne spontanée.
Possibilité d’une démence fronto-temporale, de signes cochléo-vestibulaires, signes cérébelleux
L’IRM crânio-encéphalique en permet le diagnostic par le rehaussement dural à l’injection de gadolinium
L’IRM crânio-encéphalique révèle les perturbations morphologiques de la région hypothalamo-hypophysaire.
Le traitement en est le blood-patch par abord intrathécal.
Réponses
1C, 2ACD, 3CD, 4ABC, 5
Références annotées
Dobrocky T, Nicholson P, Häni L, Mordasini P, Krings T, Brinjikji W, et al. Spontaneous intracranial hypotension : searching for the CSF leak. The Lancet Neurology. 2022 ;21(4):369-80.
Une revue de littérature incontournable décrivant l’approche diagnostique étiologique de l’hypotension intracrânienne spontanée et les différents types de fistules rachidiennes.
Ashayeri K, E MJ, Huang J, Brem H, Gordon CR. Syndrome of the Trephined : A Systematic Review. Neurosurgery. 2016 ;79(4):525-34.
Méta-analyse rétrospective de la littérature du syndrome de Tréphine.
Références
1. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia : an international journal of headache. 2018 ;38(1):1-211.
2. Idris Z, Mustapha M, Abdullah JM. Microgravity environment and compensatory : Decompensatory phases for intracranial hypertension form new perspectives to explain mechanism underlying communicating hydrocephalus and its related disorders. Asian journal of neurosurgery. 2014 ;9(1):7-13.
3. Dobrocky T, Nicholson P, Häni L, Mordasini P, Krings T, Brinjikji W, et al. Spontaneous intracranial hypotension : searching for the CSF leak. The Lancet Neurology. 2022 ;21(4):369-80.
4. Lashkarivand A, Eide PK. Brain Sagging Dementia-Diagnosis, Treatment, and Outcome : A Review. Neurology. 2022 ;98(19):798-805.
5. Schievink WI. Spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension. Jama. 2006 ;295(19):2286-96.
6. Schievink WI, Maya M, Prasad RS, Wadhwa VS, Cruz RB, Moser FG, et al. Spontaneous spinal cerebrospinal fluid-venous fistulas in patients with orthostatic headaches and normal conventional brain and spine imaging. Headache. 2021 ;61(2):387-91.
7. Bond KM, Benson JC, Cutsforth-Gregory JK, Kim DK, Diehn FE, Carr CM. Spontaneous Intracranial Hypotension : Atypical Radiologic Appearances, Imaging Mimickers, and Clinical Look-Alikes. AJNR American journal of neuroradiology. 2020 ;41(8):1339-47.
8. Ashayeri K, E MJ, Huang J, Brem H, Gordon CR. Syndrome of the Trephined : A Systematic Review. Neurosurgery. 2016 ;79(4):525-34.
9. Annan M, De Toffol B, Hommet C, Mondon K. Sinking skin flap syndrome (or Syndrome of the trephined) : A review. British journal of neurosurgery. 2015 ;29(3):314-8.
10. Joseph V, Reilly P. Syndrome of the trephined. Journal of neurosurgery. 2009 ;111(4):650-2.