#4. Gliomes de haut grade de malignité
Fabien ALMAIRAC, M.D., CHU Nice, mars 2022.
I. Epidémiologie et histoire naturelle
Les gliomes diffus de haut grade (GHG) de l’adulte regroupent les gliomes de grade 3 (ex gliomes anaplasiques) et les gliomes de grade 4 (astrocytomes et glioblastomes, GBM). Ce sont les tumeurs cérébrales primitives malignes les plus fréquentes de l’adulte et dont l’incidence en France est d’environ 5/100 000 hab/an [1]. Le pic démographique de survenue de ces tumeurs malignes est de 55-70 ans. Les gliomes sont majoritairement sporadiques, mais certaines maladies génétiques telles que le syndrome de Li-Faumeni ou de Turcot prédisposent à leur survenue [2]. Ces tumeurs ont pour particularité d’infiltrer le parenchyme cérébral sain de proche en proche, sans limite nette et de le détruire, occasionnant des déficits neurologiques plus ou moins marqués. L’évolution des GHG est péjorative et la récidive tumorale est la règle. A titre indicatif, la médiane de survie des patients atteints d’un GBM n’excède pas quelques mois en l’absence de traitement [3], elle reste inférieure à 18 mois malgré le traitement oncologique de référence [4] et la récidive survient en moyenne 7 mois après la chirurgie. Deux notions peuvent expliquer - au moins en partie - le caractère inéluctable de la récidive tumorale des gliomes diffus de l’adulte : i) la résection complète « R0 » n’est pas possible (dissémination cérébrale même à distance du site tumoral) [5] ; ii) certaines cellules tumorales ont des caractères de cellules souches leur conférant des propriétés de résistance aux traitements conventionnels et d’autorenouvellement à l’infini [6].
II. Classification histo-moléculaire de l’OMS 2021
Les gliomes diffus de l’adulte de haut grade de malignité regroupent les gliomes de grade 3 et 4 de l’OMS [7]. Ils sont issus soit de la lignée astrocytaire pour les astrocytomes IDH mutés de grade 3 et 4, et les glioblastomes IDH non mutés (autrement appelés sauvages ou wildtype), soit de la lignée oligodendrogliale pour les oligodendrogliomes de grade 3 (qui présentent à la fois la mutation IDH et la co-délétion 1p/19q).
Les critères histologiques n’ont pas été modifiés dans la nouvelle classification. Dans le cas des astrocytomes IDH mutés, un nombre total de mitoses de la pièce opératoire ≥ 2 les classe en grade 3, et la présence d’une prolifération microvasculaire ou de nécrose les classe en grade 4 (on parle alors d’astrocytome IDH muté de grade 4). Désormais, sont également considérés de grade 4 les astrocytomes IDH mutés avec une délétion homozygote de CDKN2A/B, même en l’absence de prolifération microvasculaire ou de nécrose.
Dans le cas des oligodendrogliomes IDH mutés et codélétés 1p/19q, un nombre de mitose ≥ 6 pour 10 champs à fort grossissement ou la présence d’une prolifération microvasculaire ou de nécrose les classe en grade 3.
Les glioblastomes IDH sauvages sont des astrocytomes diffus de l’adulte sans mutation IDH avec la présence soit d’une prolifération microvasculaire, soit de nécrose, soit d’une mutation du promoteur de TERT, soit d’une amplification du gène EGFR, soit d’un gain du chromosome 7 entier et perte du chromosome 10 entier, soit de l’association de ces différents critères.
Sur le plan clinique, les gliomes de haut grade IDH mutés sont supposés moins agressifs que les gliomes IDH sauvages (glioblastomes). Avec la nouvelle classification, les glioblastomes IDH mutés et les glioblastomes à composante oligodendrogliale n’existent plus.
Le tableau suivant (tableau 1) résume les caractéristiques histo-moléculaires des gliomes diffus de l’adulte selon la nouvelle classification OMS 2021.
Tableau 1 : caractéristiques histo-moléculaires des gliomes diffus de l’adulte.
| Type tumoral | Profil d’altération moléculaire/génique | Grades |
|---|---|---|
| Astrocytome, IDH muté | IDH1, IDH2, ATRX, TP53, CDKN2A/B | 2, 3, 4 |
| Oligodendrogliome, IDH muté, et co-del 1p/19q | IDH1, IDH2, 1p/19q, TERTp, CIC, FUBP1, NOTCH1 | 2, 3 |
| Glioblastome, IDH sauvage | TERTp, +7/-10, EGFR | 4 |
TERTp : promoteur de TERT ; 1p/19q co-del : co-délétion du bras court du chromosome 1 et du bras long du chromosome 19 ; +7/-10 : gain du chromosome 7 entier, perte du chromosome 10 entier.
III. Clinique
Aucun symptôme n’est spécifique des GHG (réf.2). Les symptômes au diagnostic dépendent de la topographie et du volume tumoral. En cas de tumeur volumineuse et/ou d’œdème important, les signes cliniques sont en lien avec une hypertension intracrânienne (30%). Les autres symptômes fréquemment rencontrés sont les déficits moteurs (20%), cognitifs (15%), visuels ou linguistiques (13%) [8]. L’épilepsie est moins fréquente que dans les gliomes diffus de bas grade mais représente 15 à 50% des cas [9]. Dans plus de 90% des cas, les GHG sont de topographie supratentorielle (40% dans le lobe frontal), et plus rarement dans le tronc cérébral (5%) ou le cervelet (<3%) [10].
IV. Para-clinique
L’examen de référence est l’IRM cérébrale « multimodalités » en séquences T1, T1 injectée, T2, FLAIR, diffusion, perfusion et spectroscopie (figure 1). Les objectifs de l’IRM sont multiples :
- localiser la tumeur et préciser ses rapports avec les structures anatomiques ;
- évaluer son étendue : unique, multifocal (au moins 2 foyers prenant le contraste indépendants, séparés d’au moins 1 cm), diffus avec envahissement d’au moins 3 lobes cérébraux contigus ;
- préciser ses caractéristiques : voir figure 1.
- apporter des arguments à l’encontre d’un diagnostic différentiel de toute lésion qui se rehausse après injection de produit de contraste : métastase, abcès, lymphome cérébral, radionécrose, lésion inflammatoire du SNC, foyers de contusion, ischémie ;
- faire le bilan d’éventuelles complications : hémorragie intratumorale, engagement cérébral, hydrocéphalie, méningite tumorale.
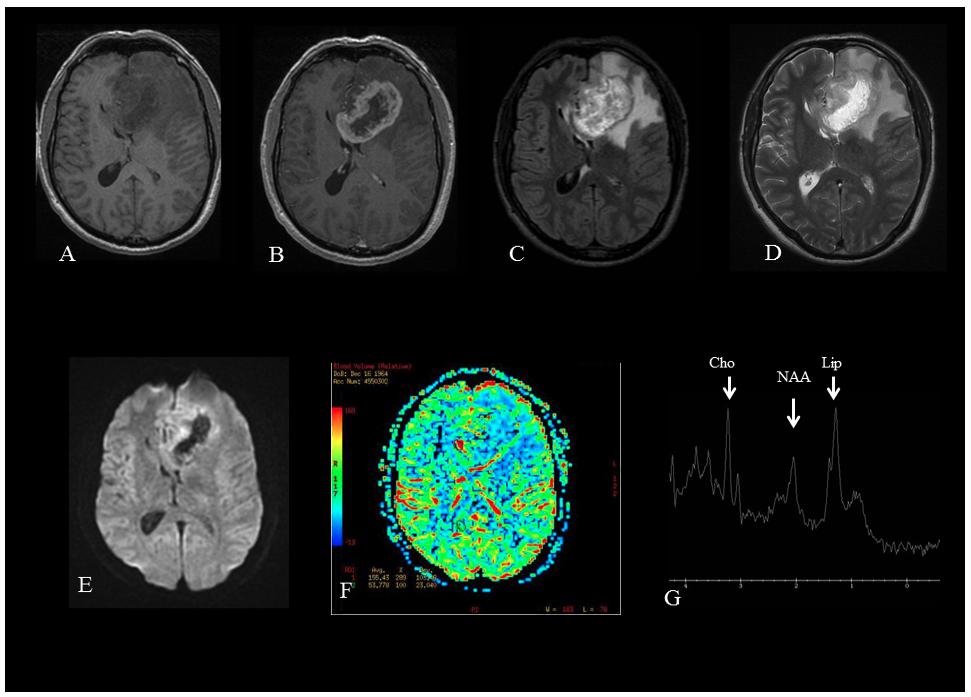
Figure 1. IRM cérébrale multimodalités pour un glioblastome fronto-calleux gauche.
A. Séquence T1 sans injection de produit de contraste (PDC) : lésion frontale gauche en hyposignal, hétérogène, avec effet de masse.
B. Séquence T1 avec injection de PDC : rehaussement périphérique hétérogène avec nécrose centrale.
C. Séquence FLAIR : lésion globalement en hypersignal hétérogène, hypersignal intraparenchymateux périlésionnel lié à l’œdème.
D. Séquence T2 : lésion hétérogène avec une périphérie en isosignal et un centre en hypersignal évocateur de nécrose kystique. Œdème périlésionnel en hypersignal.
E. Séquence de diffusion : augmentation du coefficient apparent de diffusion au centre de la tumeur en faveur d’une nécrose kystique pauci-cellulaire.
F. Cartographie de perfusion : augmentation périphérique du volume sanguin cérébral relatif (>2,9) correspondant à la zone tumorale rehaussée par l’injection de produit de contraste, et donc à la néo-angiogénèse.
G. Spectroscopie réalisée dans la zone périphérique de la tumeur : pic de choline (Cho) signant le renouvellement membranaire, abaissement du N-Acétyl Aspartate (NAA, marqueur d’intégrité neuronale), et augmentation des lipides (Lip) du fait de la présence de nécrose
V. Principes thérapeutiques
La chirurgie est l’élément clé de la prise en charge. Elle consiste idéalement en une exérèse maximaliste, sinon en une biopsie [11–14].
Après la chirurgie, le traitement oncologique adjuvant consiste en une chimiothérapie, radiothérapie (RT) ou les 2 de manière concomitante (réf.24) :
- Pour les oligodendrogliomes de grade 3, la première ligne de traitement est une radiothérapie suivie d’une chimiothérapie par du PCV (procarbazine, CCNU, vincristine), soit l’inverse [15,16].
- Pour les astrocytomes IDH mutés de grade 3, la première ligne de traitement est soit une radiothérapie puis une chimiothérapie par du TMZ (témozolomide) [17], soit une radiothérapie puis une chimiothérapie par PCV, soit une chimiothérapie par du PCV suivie d’une radiothérapie [18].
- Pour les astrocytomes IDH mutés de grade 4 et les glioblastomes IDH sauvages, le traitement de référence est la radiothérapie avec une chimiothérapie concomitante par du TMZ suivie par une chimiothérapie adjuvante par TMZ selon le protocole de Stupp [4].
A la récidive, le traitement n’est pas standardisé. La chirurgie doit toujours être envisagée si elle est possible, la 2ème ligne de chimiothérapie pourra être soit une molécule qui n’aura pas été utilisée en 1ère ligne soit la molécule utilisée en 1ère ligne si elle s’est avérée être particulièrement efficace, et les possibilités de ré-irradiation doivent également se discuter en fonction des isodoses déjà reçues. Le bévacizumab (antiangiogénique par anticorps anti-EGFR) peut avoir un effet symptomatique intéressant chez certains patients.
Les traitements symptomatiques : corticoïdes pour l’œdème vasogénique, antiépileptiques en cas de crise d’épilepsie, rééducation orthophonique et neuropsychologique à débuter précocement en postopératoire, kinésithérapie adaptée aux troubles du patient (équilibre, force motrice, proprioception).
VI. Traitement chirurgical
Même si l’intérêt oncologique d’une résection est encore débattu par certains [19], l’intérêt de l’exérèse chirurgicale pour diminuer l’effet de masse et donc améliorer l’état neurologique est reconnu. La résection doit être maximaliste, tout en épargnant le cerveau encore fonctionnel pour ne pas induire de déficit neurologique définitif ou aggraver l’état clinique du patient (réf.23). Afin d’évaluer la qualité d’exérèse de manière objective et ainsi guider le traitement adjuvant, il est indispensable de faire une IRM dans les 48 heures postopératoires, l’impression du neurochirurgien, subjective par essence, ne devant pas être utilisée pour définir la qualité de la résection [20]. L’exérèse « complète » (ou « gross total resection ») d’un GHG est définie par l’absence de prise de contraste résiduelle sur l’IRM post-opératoire immédiate, l’exérèse « subtotale » par la résection de 98% de la prise de contraste, et l’exérèse « partielle » par < 98% de la prise de contraste réséquée. Idéalement, le volume du résidu tumoral doit être mesuré en 3 dimensions [21]. Par ailleurs, de récentes études sur portant sur la résection également de l’hypersignal FLAIR autour de la prise de contraste (exérèse « supra-totale » ou « supra-marginale ») semblent démontrer un intérêt oncologique significatif [22,23].
Afin d’aider le neurochirurgien dans la résection tumorale, plusieurs outils de repérage anatomique ont été développés, chacun possédant des avantages et limites : neuronavigation IRM, échographie per-opératoire, IRM per-opératoire, fluorescence tumorale, microscope opératoire, et autres. Cependant, même si ces outils permettent d’estimer avec plus ou moins de fiabilité les limites tumorales, aucun ne permet d’identifier les réseaux éloquents pendant la résection tumorale afin les préserver (réf.23). Pour cela, la méthode de référence est la cartographie fonctionnelle (réf. 20, 21, 22) cérébrale par stimulation électrique bipolaire chez un patient éveillé [24]. Initialement développée dans la chirurgie des gliomes de bas grade, elle peut se transposer chez des patients non ou pauci-symptomatiques porteurs d’un gliome de haut grade de malignité [25].
L’annonce thérapeutique au patient et sa famille est indispensable après la discussion en RCP (ref.1).
En complément de l’exérèse chirurgicale, il est possible de réaliser une chimiothérapie locale in situ avec des implants de carmustine [26]. Cette chimiothérapie locale ne semble pertinente que dans les GHG ayant un mauvais pronostic (GBM IDH non mutés) du fait du gain de survie modeste qu’elle confère.
On optera pour une biopsie tumorale (stéréotaxique ou à ciel ouvert) lorsque l’exérèse n’est pas indiquée, qu’il existe un doute diagnostique (avec un lymphome par exemple) ou lorsqu’elle n’est pas possible : extension bilatérale, envahissement des noyaux gris centraux, du tronc cérébral, patient trop fragile (liste non exhaustive).
Les complications de la chirurgie :
Le taux de mortalité globale après craniotomie pour tumeur cérébrale varie de 1 à 2,7%, le taux de morbidité varie de 10,6% à 32% [27,28]. Le taux de déficits neurologiques tardifs liés à la chirurgie, hors chirurgie éveillée, varie de 8,1 à 20% en fonction des séries, et les complications régionales varient de 7 à 16% : épilepsie postopératoire (3 à 7,5%), hématome du foyer opératoire (2%), infection du site opératoire (1%), abcès cérébral, méningite, fuite de LCS (2%), pneumencéphalie symptomatique, hydrocéphalie. Les complications systémiques varient de 4,5% à 12,5% : thrombose veineuse profonde/embolie pulmonaire, pneumopathie infectieuse, infection urinaire.
VII. Facteurs pronostiques
Les facteurs cliniques de bon pronostic sont : l’âge (<60 ans), un KPS > 70, l’absence de déficit neurologique et cognitif (MMS ≥ 27), la localisation frontale du GHG [29].
Les facteurs pronostiques biologiques favorables sont désormais intégrés dans la classification histo-moléculaire de l’OMS 2021 : mutation de IDH et co-délétion 1p/19q en facteurs de bon pronostic et CDKN2A en facteur de mauvais pronostic. Le statut de méthylation du promoteur de MGMT est un facteur prédictif de réponse aux agents alkylants anticancéreux tels que le témozolomide (TMZ), la procarbazine ou le CCNU [30].
POINTS FORTS
- Les gliomes de haut grade constituent un groupe hétérogène de tumeurs au pronostic variable que les marqueurs moléculaires tendent à préciser
- La chirurgie d’exérèse est le traitement de référence des gliomes de haut grade, en première ligne et à la récidive
- La chirurgie d’exérèse des gliomes de haut grade permet de diminuer les symptômes neurologiques, de réduire le volume tumoral (intérêt oncologique), et d’obtenir l’histologie tumorale
- La cartographie cérébrale par stimulation électrique directe peut être utilisée pour guider la résection des gliomes de haut grade dans le but de réduire le risque de séquelle neurologique post-opératoire et éventuellement de réséquer tout ou partie de l’hypersignal FLAIR en plus de la prise de contraste tumorale
- Le traitement adjuvant des gliomes de haut grade dépend de l’âge et du statut neurologique du patient, du type et du grade histologique de la tumeur
POINTS FAIBLES
- Les gliomes de haut grade de malignité sont les tumeurs cérébrales primitives malignes les plus fréquentes et les plus agressives de l’adulte, au pronostic toujours sombre
- Ce sont des tumeurs infiltrantes agressives sans limites nettes et occasionnant volontiers des déficits neurologiques par destruction neuronale
- Bien que les marqueurs histo-moléculaire se soient développés ces 20 dernières années et soient désormais intégrés dans la classification OMS, les facteurs pronostics manquent de fiabilité à l’échelon individuel
Réponses QCM
QCM 1
Réponses : D, E
QCM 2
Réponses : A, B, C, E
QCM 3
Réponses : B, D
QCM 4
Réponses : B, E
QCM 5
Réponses : A
REFERENCES
[1] Darlix A, Zouaoui S, Rigau V, Bessaoud F, Figarella-Branger D, Mathieu-Daudé H, et al. Epidemiology for primary brain tumors : a nationwide population-based study. J Neurooncol 2017 ;131:525–46. https://doi.org/10.1007/s11060-016-2318-3.
[2] Almairac F, Frenay M, Paquis P. [Genetic diseases and glioblastomas]. Neurochirurgie 2010 ;56:455–8. https://doi.org/10.1016/j.neuchi.2010.07.007.
[3] Ampil FL, Nanda A, Willis BK, Apple S. Treatment in patients with glioblastoma multiforme and poor performance status : is it worthwhile ? Radiat Med 1998 ;16:109–12.
[4] Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJB, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005 ;352:987–96. https://doi.org/10.1056/NEJMoa043330.
[5] Kelly PJ, Daumas-Duport C, Kispert DB, Kall BA, Scheithauer BW, Illig JJ. Imaging-based stereotaxic serial biopsies in untreated intracranial glial neoplasms. J Neurosurg 1987 ;66:865–74. https://doi.org/10.3171/jns.1987.66.6.0865.
[6] Almairac F, Turchi L, Sakakini N, Debruyne DN, Elkeurti S, Gjernes E, et al. ERK-Mediated Loss of miR-199a-3p and Induction of EGR1 Act as a “Toggle Switch” of GBM Cell Dedifferentiation into NANOG- and OCT4-Positive Cells. Cancer Res 2020 ;80:3236–50. https://doi.org/10.1158/0008-5472.CAN-19-0855.
[7] Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System : a summary. Neuro-Oncol 2021 ;23:1231–51. https://doi.org/10.1093/neuonc/noab106.
Dans cette mise à jour de la classification OMS des tumeurs du SNC, les gliomes diffus de l’adulte ont encore une fois subi des changements. Désormais, les glioblastomes IDH mutés ont été rebaptisés astrocytomes IDH mutés de grade 4, et les glioblastomes moléculaires (gain du 7, perte du 10 et/ou amplification d’EGFR et/ou mutation de TERT) sont regroupés sous la terminologie glioblastomes IDH non-muté qu’ils aient ou non une prolifération microvasculaire et/ou de la nécrose.
[8] Yuile P, Dent O, Cook R, Biggs M, Little N. Survival of glioblastoma patients related to presenting symptoms, brain site and treatment variables. J Clin Neurosci Off J Neurosurg Soc Australas 2006 ;13:747–51. https://doi.org/10.1016/j.jocn.2005.10.011.
[9] Vecht CJ, Kerkhof M, Duran-Pena A. Seizure prognosis in brain tumors : new insights and evidence-based management. The Oncologist 2014 ;19:751–9. https://doi.org/10.1634/theoncologist.2014-0060.
[10] Larjavaara S, Mäntylä R, Salminen T, Haapasalo H, Raitanen J, Jääskeläinen J, et al. Incidence of gliomas by anatomic location. Neuro-Oncol 2007 ;9:319–25. https://doi.org/10.1215/15228517-2007-016.
[11] Almenawer SA, Badhiwala JH, Alhazzani W, Greenspoon J, Farrokhyar F, Yarascavitch B, et al. Biopsy versus partial versus gross total resection in older patients with high-grade glioma : a systematic review and meta-analysis. Neuro-Oncol 2015 ;17:868–81. https://doi.org/10.1093/neuonc/nou349.
[12] Stummer W, Reulen H-J, Meinel T, Pichlmeier U, Schumacher W, Tonn J-C, et al. Extent of resection and survival in glioblastoma multiforme : identification of and adjustment for bias. Neurosurgery 2008 ;62:564–76 ; discussion 564-576. https://doi.org/10.1227/01.neu.0000317304.31579.17.
Cet article fait suite à l’essai randomisé comparant l’utilisation du 5-ALA versus lumière blanche paru dans Lancet Oncology en 2006 (PMID : 16648043), et a permis de démontrer avec un niveau de preuve B que la survie globale et la survie sans progression étaient supérieurs dans le groupe résection complète que dans le groupe résection incomplète.
[13] Vuorinen V, Hinkka S, Färkkilä M, Jääskeläinen J. Debulking or biopsy of malignant glioma in elderly people - a randomised study. Acta Neurochir (Wien) 2003 ;145:5–10. https://doi.org/10.1007/s00701-002-1030-6.
Bien que l’effectif soit restreint (n=30) et ne concerne que les patients de plus de 65 ans, il s’agit du seul essai randomisé comparant la résection à la biopsie d’un gliome de haut grade. La survie globale est supérieure dans le groupe résection que dans le groupe biopsie (171 jours vs 85, p=0,035).
[14] Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini A, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol 2014 ;15:e395-403. https://doi.org/10.1016/S1470-2045(14)70011-7.
[15] van den Bent MJ, Brandes AA, Taphoorn MJB, Kros JM, Kouwenhoven MCM, Delattre J-Y, et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma : long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol Off J Am Soc Clin Oncol 2013 ;31:344–50. https://doi.org/10.1200/JCO.2012.43.2229.
[16] Cairncross G, Wang M, Shaw E, Jenkins R, Brachman D, Buckner J, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma : long-term results of RTOG 9402. J Clin Oncol Off J Am Soc Clin Oncol 2013 ;31:337–43. https://doi.org/10.1200/JCO.2012.43.2674.
[17] van den Bent MJ, Tesileanu CMS, Wick W, Sanson M, Brandes AA, Clement PM, et al. Adjuvant and concurrent temozolomide for 1p/19q non-co-deleted anaplastic glioma (CATNON ; EORTC study 26053-22054) : second interim analysis of a randomised, open-label, phase 3 study. Lancet Oncol 2021 ;22:813–23. https://doi.org/10.1016/S1470-2045(21)00090-5.
[18] Wick W, Roth P, Hartmann C, Hau P, Nakamura M, Stockhammer F, et al. Long-term analysis of the NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with PCV or temozolomide. Neuro-Oncol 2016 ;18:1529–37. https://doi.org/10.1093/neuonc/now133.
[19] Hart MG, Grant GR, Solyom EF, Grant R. Biopsy versus resection for high-grade glioma. Cochrane Database Syst Rev 2019 ;6:CD002034. https://doi.org/10.1002/14651858.CD002034.pub2.
[20] Garcia-Ruiz A, Naval-Baudin P, Ligero M, Pons-Escoda A, Bruna J, Plans G, et al. Precise enhancement quantification in post-operative MRI as an indicator of residual tumor impact is associated with survival in patients with glioblastoma. Sci Rep 2021 ;11:695. https://doi.org/10.1038/s41598-020-79829-3.
[21] Pallud J, Taillandier L, Capelle L, Fontaine D, Peyre M, Ducray F, et al. Quantitative morphological magnetic resonance imaging follow-up of low-grade glioma : a plea for systematic measurement of growth rates. Neurosurgery 2012 ;71:729–39 ; discussion 739-740. https://doi.org/10.1227/NEU.0b013e31826213de.
[22] Eyüpoglu IY, Hore N, Merkel A, Buslei R, Buchfelder M, Savaskan N. Supra-complete surgery via dual intraoperative visualization approach (DiVA) prolongs patient survival in glioblastoma. Oncotarget 2016 ;7:25755–68. https://doi.org/10.18632/oncotarget.8367.
[23] Li YM, Suki D, Hess K, Sawaya R. The influence of maximum safe resection of glioblastoma on survival in 1229 patients : Can we do better than gross-total resection ? J Neurosurg 2016 ;124:977–88. https://doi.org/10.3171/2015.5.JNS142087.
[24] Duffau H. Stimulation mapping of white matter tracts to study brain functional connectivity. Nat Rev Neurol 2015 ;11:255–65. https://doi.org/10.1038/nrneurol.2015.51.
[25] Zhang JJY, Lee KS, Voisin MR, Hervey-Jumper SL, Berger MS, Zadeh G. Awake craniotomy for resection of supratentorial glioblastoma : a systematic review and meta-analysis. Neuro-Oncol Adv 2020 ;2:vdaa111. https://doi.org/10.1093/noajnl/vdaa111.
[26] Westphal M, Hilt DC, Bortey E, Delavault P, Olivares R, Warnke PC, et al. A phase 3 trial of local chemotherapy with biodegradable carmustine (BCNU) wafers (Gliadel wafers) in patients with primary malignant glioma. Neuro-Oncol 2003 ;5:79–88. https://doi.org/10.1093/neuonc/5.2.79.
[27] Sawaya R, Hammoud M, Schoppa D, Hess KR, Wu SZ, Shi WM, et al. Neurosurgical outcomes in a modern series of 400 craniotomies for treatment of parenchymal tumors. Neurosurgery 1998 ;42:1044–55 ; discussion 1055-1056.
[28] Vorster SJ, Barnett GH. A proposed preoperative grading scheme to assess risk for surgical resection of primary and secondary intraaxial supratentorial brain tumors. Neurosurg Focus 1998 ;4:e2.
[29] Fontaine D, Paquis P. [Glioblastoma : clinical, radiological and biological prognostic factors]. Neurochirurgie 2010 ;56:467–76. https://doi.org/10.1016/j.neuchi.2010.07.008.
[30] Weller M, van den Bent M, Preusser M, Le Rhun E, Tonn JC, Minniti G, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol 2021 ;18:170–86. https://doi.org/10.1038/s41571-020-00447-z.