#6. Lymphome primitif du Système Nerveux Central
Charles-Henry MALLEREAU, M.D., Hélène CEBULA, M.D., Ph.D., CHU Strasbourg. Mars 2022.
QCMs
1. A propos du lymphome primitif du SNC :
A. Il s’agit d’un lymphome non hodgkinien.
B. L’incidence est de 0,5/100 000 habitants par an.
C. Il touche essentiellement l’adulte immunodéprimé.
D. Le pic d’incidence est entre 30 et 50 ans.
E. La localisation oculaire est associée dans 20-25% des cas à la localisation cérébrale.
2. Présentation radiologique :
A. Une tumeur de localisation périventriculaire doit faire évoquer le lymphome primitif du SNC jusqu’à preuve du contraire.
B. La lésion apparaît spontanément hyperdense sur le scanner.
C. L’IRM en séquence diffusion met en évidence un hyper signal diffusion avec un ADC haut.
D. La séquence de perfusion objective fréquemment une rupture de la barrière hémato-encéphalique.
E. La spectro IRM met en évidence une augmentation du rapport Choline/ NAA et choline/ créatinine ainsi que la présence d’un pic Lipides-Lactates.
3. Stratégie diagnostique :
A. La corticothérapie risque de négativer le prélèvement histologique.
B. La biopsie cérébrale est toujours indispensable.
C. Un prélèvement du vitré positif (cytologie, immunophénotypage et biologie moléculaire) associé à une imagerie typique peut suffire au diagnostic.
D. L’examen ophtalmologique par la réalisation d’un fond d’œil doit être systématique..
E. L’IRM médullaire n’est réalisée qu’en cas de point d’appel clinique.
4-Prise en charge :
A. Le traitement de 1ère intention repose sur le Méthotrexate faible dose.
B. La cytarabine forte dose est un des traitements de 1ère ligne.
C. En cas de réponse complète, une simple surveillance peut être retenue.
D. La chimiothérapie intensive associée à une greffe autologue de cellules souches peut être utilisée en cas de réponse partielle ou de rechute.
E. La radiothérapie est toujours utilisée en 1ère intention.
5. Scores pronostiques :
A. Il existe deux scores pronostiques : MSKCC et IELSG pour prédire le pronostic et mieux stratifier les patients dans les essais cliniques.
B. Le score MSKCC distingue trois groupes sur la base de l’âge et du statut de performance de Karnofsky.
C. Le score l’IELSG utilise cinq paramètres : l’âge, le score de performance de l’ECOG, taux de lactate déshydrogénase, la concentration de protéines dans le LCR et l’atteinte cérébrale profonde.
D. Le score l’IELSG distingue trois groupes : favorable, intermédiaire et défavorables.
E. Selon le score IELSG, un patient avec un statut favorable (0-1 facteur) aurait 80 % de survie à 5 ans.
1. GENERALITES
Le lymphome primitif du système nerveux central (SNC) est un lymphome non hodgkinien de haut grade se développant essentiellement au niveau du cerveau (95%) mais aussi au niveau de la moelle. Il est retrouvé de manière synchrone au niveau du liquide céphalo-rachidien (33%) ou au niveau oculaire (20-25% de lymphome oculo-cérébraux)[1].
L’incidence est de 0,5/100 000 habitants par an. Il représente 4 % de toutes les tumeurs intracrâniennes et 4 à 6 % des lymphomes extranodaux [1].
Il touche l’âge adulte, immunodéprimé et immunocompétent, avec un pic entre 50 et 60 ans et une prédominance masculine (ratio Homme/ Femme entre 1,2 et 1,7) [2].
2. ANATOMOPATHOLOGIE ET BIOLOGIE MOLECULAIRE
Le lymphome primitif du SNC est un lymphome diffus à grandes cellules B [3]. En microscopie optique, on retrouve un infiltrat diffus de cellules lymphomateuses dans le parenchyme cérébral centré par des vaisseaux. Il peut exister un infiltrat de lymphocytes réactionnels, de macrophages, d’astrocytes et de cellules microgliales. Les cellules tumorales présentent un état de différenciation correspondant aux cellules B de sortie tardive du centre germinal [4] et, à ce titre, expriment des protéines spécifiques qui peuvent être exploitées comme marqueurs diagnostiques. En plus de l’expression des marqueurs des cellules type B (CD19, CD20 et CD79a), les cellules de lymphome expriment BCL6 et MUM1 (>90%) dans la plupart des cas. L’expression des protéines associées à la différenciation des plasmocytes (CD38, CD138) est absente. Les cellules tumorales peuvent également exprimer CD10 et BCL2 [3]. Ils ont typiquement un taux de prolifération élevé (indice prolifératif Ki-67 >70%). Les cellules tumorales expriment les marqueurs des centres germinaux, principalement BCL6 et MUM1/IRF4, mais pas les marqueurs des plasmocytes (CD38, CD138). Elles présentent une restriction de la chaîne légère et expriment les IgM, mais pas les IgG [5].
3. PRESENTATION CLINIQUE
La symptomatologie varie en fonction de la localisation de la lésion. Des déficits neurologiques focaux sont retrouvés dans 70% des cas lors d’une implication parenchymateuse [6]. 43 % des patients présenteront des changements comportementaux et troubles neurocognitifs non spécifiques pouvant être à l’origine de retard diagnostic. L’hypertension intracrânienne est retrouvée dans 33 % des cas : céphalées, ralentissement, vomissements. Enfin, les crises d’épilepsie sont rarement retrouvées : 14 % en raison d’une atteinte corticale peu fréquente [6].
L’atteinte oculaire (20-25%) est rarement symptomatique (4%) et peu spécifique : baisse d’acuité visuelle ou vision floue [7].
La localisation leptoméningée est généralement asymptomatique [8].
Des lésions au niveau médullaires peuvent être retrouvées et sont responsable de symptômes similaires aux tumeurs intramédullaires : faiblesse sensitive, motrice et sphinctérienne.
4. PRESENTATION RADIOLOGIQUE
L’IRM encéphalique est l’examen de référence pour le diagnostic avec la réalisation des séquences : T1 sans et avec injection de gadolinium, séquence pondérée en diffusion (DWI), séquence de susceptibilité magnétique (SWI), spectro-IRM, séquence de perfusion.
La présentation classique est une lésion unique sus-tentorielle de taille > 2 cm avec une proximité méningée ou épendymaire. Les localisations préférentielles du lymphome sont par ordre décroissant : lobes frontaux, lobes pariétaux, corps calleux et noyaux gris centraux.
La lésion apparaît discrètement hyperdense sur le scanner avec prise de contraste intense et homogène. On retrouve un œdème péri-lésionnel et un effet de masse modéré [9].
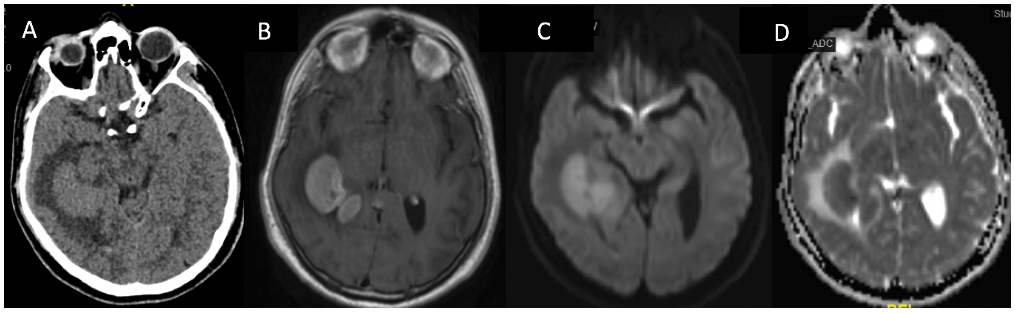
On retrouve sur l’IRM un iso ou hypo-signal T2 avec un aspect « d’empreinte de la tumeur au sein de l’œdème » et sur les séquences T1 avec injection de gadolinium induisant un rehaussement intense et homogène (voir figure 1). Le signal évolue souvent rapidement avec une croissance rapide. La localisation est souvent plurifocale (50% des cas) et on retrouve classiquement une infiltration péri-ventriculaire[9]. On peut retrouver un certain nombre d’atypies : nécrose, remaniements hémorragiques, localisation ou extension atypique. L’IRM en séquence diffusion met en évidence un hypersignal diffusion avec un ADC (pente d’atténuation du signal T2 ) bas, témoignant d’une hyper-cellularité.
Figure 1 Imagerie typique : A) TDM crâne sans injection de produit de contraste : iso/discrètement hyperdense avec œdème péri-lésionnel ; B) IRM crâne T1 avec injection de gadolinium : prise de contraste multifocale péri- ventriculaire ; C,D) IRM séquence diffusion avec ADC : hypersignal diffusion de la lésion avec ADC bas.
L’IRM de perfusion a un intérêt majeur pour distinguer le lymphome d’un gliome. En effet, on retrouve dans la pathologie lymphomateuse sur les images IRM en séquence perfusion une absence de néo-angiogenèse avec un rCBV (relative Cerebral Blood Flow) bas < 200 [10] (voir figure 2).
On constate également une extravasation du produit de contraste par rupture de la barrière hémato-encéphalique (BHE) avec une courbe caractéristique par le passage au-dessus de la ligne de base (voir figure 2).
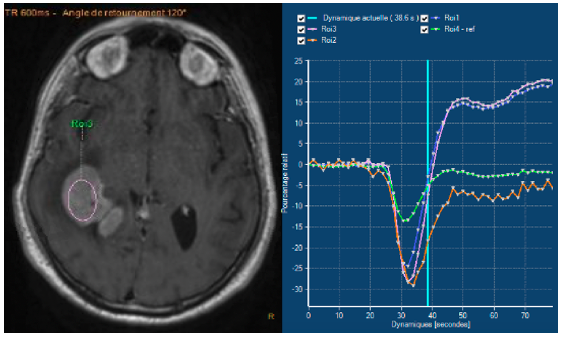
Figure 2 : IRM séquence de perfusion : la lésion suspecte (entourée en rose) présente un aspect typique de rupture de BHE (courbe rose).
A contrario, les gliomes ont un rCBV élevé au niveau des zones de néo-angiogénèse avec un retour à la ligne de base.
Toutefois, 25 % des lymphomes primitifs du SNC n’ont pas ce profil radiologique typique [10]. Enfin, la spectro IRM permet de retrouver certains éléments : augmentation du rapport Choline/ NAA- (N-Acetyl-Aspartate) et choline/ créatinine ; présence d’un pic Lipides-Lactates et enfin un spectre de tumeur de haut grade non spécifique.
4. STRATEGIE DIAGNOSTIQUE
Le diagnostic nécessite une confirmation histopathologique par biopsie cérébrale (marqueurs immunohistochimiques requis (pan-B-cell markers (CD19, CD20, PAX5), BCL6, MUM1/IRF4, et CD10). La biopsie est indispensable sauf si on retrouve une imagerie encéphalique typique associée à un prélèvement du vitré positif (cytologie, immunophénotypage et biologie moléculaire) ou à un prélèvement de LCR positif (cytologie, cytométrie de flux).
Les corticoïdes doivent être évités avant la biopsie car il existe un risque majeur de négativer le prélèvement.
Une IRM médullaire injectée doit être réalisée uniquement en cas de point d’appel clinique. Une stadification systémique de la pathologie doit être réalisée et inclure : examen physique, sérologie VHB, VHC, VIH, bilan biologique complet (bilan hématologique, rénal, hépatique), immunophénotypage lymphocytaire du sang, électrophorèse des protéines plasmatiques et immunofixation, ponction lombaire (cytologie, cytométrie en flux, recherche de biomarqueurs spécifiques), examen ophtalmologique systématique (fond d’œil +/- angiographie), biopsie ostéo-médullaire, échographie testiculaire, TDM TAP et TEP TDM 18 FDG[11].
5. STRATEGIE THERAPEUTIQUE
La chirurgie a traditionnellement été considérée comme n’ayant aucun rôle dans le traitement du lymphome primaire du SNC, en raison de son caractère infiltrant et multifocale. Un essai de phase 3 du G-PCNSL-SG-17 comprenant une proportion anormalement élevé de patients opérés a permis une analyse rétrospective et a mis en évidence des résultats à tendance favorable sur la survie mais non significatif après ajustement sur la survie globale [12].
La prise en charge de 1ère intention repose sur le Methotrexate (MXT), un antifolate et un antimétabolite, administré par voie intraveineuse à haute dose. Le méthotrexate doit être administré par perfusion intraveineuse pendant 2 à 3 heures pour un minimum de quatre à six injections et à des intervalles qui ne doivent pas dépasser 2 à 3 semaines [11]. Le Methotrexate est associé à la Cytarabine forte dose (molécule capable de traverser la barrière hémato-encéphalique) en 1ère intention [11] chez les patients jeunes et en bon état général.
La chimiothérapie intrathécale (intralombaire ou de préférence intraventriculaire par le biais d’un réservoir d’Ommaya) peut être proposée lorsqu’une atteinte méningée est documentée, et si une réponse insuffisante à une chimiothérapie intraveineuse par Methotrexate haute dose est observée.
Traitement induction : MXT +/- cytarabine forte dose
Si réponse complète (3 options selon l’âge et l’état général) :
1-surveillance,
2-consolidation par irradiation encéphale in toto (23 à 30 Gy)
3-chimiothérapie intensive associée à une greffe autologue de cellules souches périphériques.
Si réponse partielle (2 options selon l’âge et l’état général) :
1-consolidation par irradiation encéphale in toto (40Gy)
2-chimiothérapie intensive associée à une greffe autologue de cellules souches périphériques.
Le traitement lors d’une progression / rechute dépend du délai à la rechute, des précédentes lignes de traitement, de l’âge et de l’état général. Ces rechutes sont le plus souvent de mauvais pronostic et l’inclusion dans un essai thérapeutique, lorsqu’elle est possible, est fortement recommandée. [11].
6.PRONOSTIC
Pour prédire le pronostic et mieux stratifier les patients dans les essais cliniques, deux systèmes de notation sont utilisés : le score de l’International Extranodal Lymphoma Study Group (IELSG) [13] et le score pronostique du Memorial Sloan Kettering Cancer Center (MSKCC) [14]. Le score l’IELSG utilise cinq paramètres (âge, score de performance de l’Eastern Cooperative Oncology Group, taux de lactate déshydrogénase, concentration de protéines dans le LCR et atteinte cérébrale profonde) [13].
Favorable (0 à 1 facteurs ) : 80 % de survie à 5 ans.
Intermédiaire (2 à 3 facteurs) : 48 % de survie à 5 ans.
Défavorable (4 à 5 facteurs) : 15 % de survie à 5 ans.
Le score MSKCC distingue trois groupes sur la base de l’âge et du statut de performance de Karnofsky (KPS) [14] :
-Age ≤ 50 ans : survie globale médiane de 5,2-8,5 ans
-Age > 50 ans associé à un KPS ≥ 70 : survie globale médiane de 2,1-3,2 ans
-Age > 50 ans associé à un KPS < 70 : survie globale médiane de 0,9-1,1 ans.
REPONSES AUX QCMS
1-ABE
2-ABDE
3-ACDE
4-BCD
5-ABCDE
Littérature marquante
Hoang-Xuan K, Bessell E, Bromberg J, Weller M, for the European Association for Neuro-oncology Task. Force Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients : guidelines from the European Association for Neuro-Oncology. Lancet Oncol 2015 Jul ;16(7):e322-32
En 2013, l’Association européenne de neuro-oncologie a créé un groupe de travail multidisciplinaire pour établir des lignes directrices fondées sur des données probantes pour les adultes immunocompétents atteints d’un lymphome primitif du SNC. Cette revue décrit les lignes directrices, qui fournissent des considérations et des recommandations consensuelles pour le diagnostic, l’évaluation, la stadification et le traitement du lymphome primaire du SNC.
Bibliographie
[1] Villano JL, Koshy M, Shaikh H, Dolecek TA, McCarthy BJ. Age, gender, and racial differences in incidence and survival in primary CNS lymphoma. Br J Cancer. 2011 ;105(9):1414–1418.
[2] Shiels MS, Pfeiffer RM, Besson C, et al. . Trends in primary central nervous system lymphoma incidence and survival in the U.S. Br J Haematol. 2016 ;174(3):417–424.
[3] Kluin PC, Deckert M, Ferry JA. Primary diffuse large B-cell lymphoma of the CNS. In : Swerdlow S, Campo E, Harris NL, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissue (IARC WHO Classification of Tumours). Lyon, France : IARC, 2008 ;240Y41
[4] Montesinos-Rongen M, Brunn A, Bentink S, et al. Gene expression profiling suggests primary central nervous system lymphomas to be derived from a late germinal center B cell. Leukemia 2008, volume 22, pages400–405
[5] Brunn A, Nagel I, Montesinos-Rongen M, et al. Frequent triple-hit expression of MYC, BCL2, and BCL6 in primary lymphoma of the central nervous system and absence of a favorable MYC(low)BCL2 (low) subgroup may underlie the inferior prognosis as compared to systemic diffuse large B cell lymphomas. Acta Neuropathol. 2013 ;126:603–605.
[6] Bataille B, Delwail V, Menet E, et al. . Primary intracerebral malignant lymphoma : report of 248 cases. J Neurosurg. 2000 ;92(2):261–266.
[7] Hong JT, Chae JB, Lee JY, Kim JG, Yoon YH. Ocular involvement in patients with primary CNS lymphoma. J Neurooncol. 2011, 102(1):139-45
[8] Balmaceda C, Gaynor JJ, Sun M, Gluck JT, DeAngelis LM. Leptomeningeal tumor in primary central nervous system lymphoma : recognition, significance, and implications. Ann Neurol. 1995 ;38(2):202-9.
[9] Cheng G, Zhang J. Imaging features (CT, MRI, MRS, and PET/CT) of primary central nervous system lymphoma in immunocompetent patients. Neurol Sci. 2019 ; 40(3):535-542
[10] Hartmann M, Heiland S, Harting I, Tronnier V M, Sommer C, Ludwig R, Sartor K. Distinguishing of primary cerebral lymphoma from high-grade glioma with perfusion-weighted magnetic resonance imaging. Neuroscience Letters, 01 Feb 2003, 338(2):119-122
[11] Hoang-Xuan K, Bessell E, Bromberg J, Weller M, for the European Association for Neuro-oncology Task. Force Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients : guidelines from the European Association for Neuro-Oncology.
Lancet Oncol 2015 Jul ;16(7):e322-32
[12] Weller M, Martus P, Roth P, Thiel E, Korfel A, German PCNSL Study Group. Surgery for primary CNS lymphoma ? Challenging a paradigm. Neuro Oncol. 2012 Dec ;14(12):1481-4
[13] Ferreri AJ, Blay JY, Reni M, et al. : Prognostic scoring system for primary CNS lymphomas : The International Extranodal Lymphoma Study Group experience. J Clin Oncol 21:266-272, 2003
[14] Abrey LE, Ben-Porat L, Panageas KS, et al. : Primary central nervous system lymphoma : The Memorial Sloan-Kettering Cancer Center prognostic model. J Clin Oncol 24:5711-5715, 2006