Fistules artério-veineuses durales intracrâniennes
Rédigé en avril 2014 par Klauss Mourrier et Appoline KAZEMI, CHU Dijon
Définition
Les fistules artério-veineuses durales (FAVD) représentent 10 à 15 % des shunts artério-veineux intracrâniens (4). Il s’agit d’un groupe hétérogène de shunts artério-veineux répondant à 3 critères toujours présents :
– les afférences artérielles proviennent toujours d’artères à destinée extra-encéphalique, qu’il s’agisse de branches méningées d’artères extra-crâniennes, ou de branches méningées d’artères intracrâniennes.
– le nidus, ou la zone de shunt, est situé dans l’épaisseur de la dure-mère. Il est toujours extra parenchymateux.
– le drainage veineux est intracrânien, empruntant un sinus veineux ou une veine lepto-méningée.
Ils ont été longtemps apparentés aux malformations artério-veineuses (MAV) dans la mesure où il existe des shunts artério-veineux et où ils peuvent être responsables d’hémorragies intracrâniennes. Cependant les 3 critères cités plus haut les en différencient, de même que leur origine acquise reconnue, et leur association fréquente avec des thrombophlébites cérébrales.
Historique
Jusque dans les années 1960, les FAVD étaient confondues avec les MAV cérébrales, et représentaient 10 à 15 % d’entre elles (4) ; elles étaient considérées comme des malformations congénitales. A cette époque, Newton met en évidence l’origine extra crânienne des afférences artérielles (45). En 1973, Aminoff séparait les FAVD des MAV en localisant le shunt dans l’épaisseur de la dure mère (1) et en 1976, Castaigne relevait que le risque hémorragique était corrélé avec l’existence d’un drainage veineux cortical (14) En 1977, Djindjian et Merland établissait une première classification des FAVD basée sur le type de drainage veineux (18) et confirmaient qu’un drainage dans un sinus veineux n’entrainait que des symptômes fonctionnels, alors qu’un drainage veineux cortical représentait un risque fonctionnel et hémorragique - donc vital - élevé.
Histoire naturelle
L’évolution spontanée et les risques fonctionnel et vital représentés par la présence d’une FAVD intracrânienne sont controversés dans la littérature dans où on observe de grandes divergences. En fait, ceci s’explique par la relative hétérogénéité des FAVD corrélée à une hétérogénéité de leur histoire naturelle. Ainsi, selon les différents biais de sélection qui ont pu intervenir dans les séries de patients, on trouve des résultats très discordants. Schématiquement, on peut distinguer un groupe de FAVD dont le drainage veineux se fait uniquement dans un sinus veineux sans reflux cortical, d’un second groupe de FAVD avec reflux cortical soit direct, soit via un sinus veineux.
Pour le premier groupe, il n’y a pas de risque vital, pas de risque hémorragique, et pas de risque fonctionnel invalidant. Dans la plupart des cas, elles sont non symptomatiques (découvertes fortuites) ou révélées par un symptôme non invalidant objectivement comme des acouphènes pulsatiles (57,61). Le risque de l’évolution d’une FAVD de ce type vers une FAVD avec reflux cortical n’a jamais été mis en évidence de façon spontanée ; il a cependant été observé des modifications du drainage veineux après des évènements iatrogènes (chirurgicaux, ou traitements endovasculaires partiels) ou lors de l’apparition de circonstances favorisantes (thrombose veineuse) (16,71). Des cas de guérison spontanée sont aussi observés dans presque 22 % des cas par certains auteurs (25,26)
Il faut mettre à part les FAVD du sinus caverneux pour lesquelles le risque fonctionnel ophtalmologique est certain en l’absence de tout reflux veineux cortical (27).
Pour le second groupe de FAVD, il existe un retour veineux cortical soit direct, soit via un sinus veineux à contre-courant : il y aura alors gêne plus ou moins importante au retour veineux encéphalique, hyperpression sanguine dans le secteur veineux intracrânien et éventuellement aussi, des phénomènes d’ischémie veineuse (21,31). La présence d’un reflux veineux cortical conditionne l’apparition de manifestations cliniques sévères et évolutives, d’accidents hémorragiques et de thromboses veineuses graves (36). La fréquence de ces accidents hémorragiques est diversement appréciée dans la littérature mais va de 2 à 15 % /an. En tous cas, ce risque est estimé 20 fois supérieur à celui des FAVD sans reflux cortical. D’autre part, de nombreux auteurs estiment que 20 à 50 % des patients porteurs d’une telle FAVD rompue récemment, vont présenter une récidive hémorragique dans les 3 semaines suivantes (19,36,39,40,57,62).
En dehors des accidents hémorragiques, d’autres manifestations neurologiques graves dues au mauvais drainage et à l’hyperpression veineuse sont décrites dans 40 à 97 % des cas selon le retentissement veineux cortical de la FAVD (12).
Epidémiologie
Les fistules artério-veineuses durales (FAVD) représentent 10 à 15 % des shunts artério-veineux intracrâniens, surviennent dans 61 à 66 % des cas chez des femmes, et le pic de fréquence des manifestations cliniques se situe au cours de la 5ème décennie (3,4,16)
Principes physiopathologiques du processus pathologique
1/ Angioarchitecture des FAVD
Il s’agit d’un shunt de type artériolo-veineux : un réseau afférent plus ou moins complexe d’artérioles drainé dans une grosse veine artérialisée.
– Secteur artériel afférent : il est constitué d’artérioles multiples ayant pour origine des artères à destination méningée (jamais à destination parenchymateuse) plus ou moins à distance du point de shunt ; la participation d’artères controlatérales à la fistule n’est pas rare.
Toutes ces artérioles convergent vers un point de shunt, le nidus.
– Nidus : situé dans l’épaisseur de la dure mère, il est parfois étendu ; il peut être localisé dans la paroi d’un sinus veineux, ou dans tout autre secteur de la dure mère.
– Efférences veineuses : le nidus se draine dans un collecteur veineux unique, artérialisé, soit par l’intermédiaire d’un sinus veineux, soit directement dans une veine corticale leptoméningée, qui peut ensuite, en aval, se diviser en plusieurs branches. Du fait des contraintes hémodynamiques, ces veines peuvent présenter des ectasies plus ou moins volumineuses et plus ou moins complexes (71). La rupture de ces veines est responsable des accidents hémorragiques intracrâniens.
Cette angioarchitecture permet de comprendre que l’occlusion d’une FAVD peut être obtenue soit par un abord artériel nécessitant la fermeture de toutes les artérioles afférentes, soit par la fermeture du collecteur veineux à son origine, mettant en hyperpression temporaire le nidus intradural (donc sans risque de rupture intracrânienne) et aboutissant à une thrombose rétrograde du nidus et des artérioles afférentes (8,13,23,28,34,70,72)
2/Eléments d’anatomie et de physiopathologie
Initialement considérées, avec les angiomes ou malformations artério-veineuses (MAV), comme des anomalies congénitales, elles en ont été progressivement différenciées, et sont actuellement décrites dans toute la littérature comme des lésions acquises. En témoigne l’âge moyen de découverte des FAVD, ainsi que de nombreuses observations où ce caractère acquis a semblé démontré (12,15,17,30.
– Microvascularisation durale : la dure mère est richement vascularisée, par un réseau primaire constitué des principales artères méningées organisées en une trame contenant de nombreuses anastomoses. Il donne naissance à plusieurs réseaux secondaires : à destinée osseuse, à un réseau anastomotique secondaire, à des perforantes (rejoignant la profondeur de la dure mère, au contact de l’arachnoïde) et à des shunts artérioveineux selon Kerber et Newton (33). Ces microshunts connectent directement des artères superficielles avec leurs veines satellites ou avec les sinus veineux (42). Dans des circonstances pathologiques, l’ouverture de ces shunts préexistants aboutirait à la formation d’une FAVD. Roland et Bracard (55) ne retrouvent pas ces shunts, mais décrivent une riche vascularisation dans laquelle les veines sont en contact étroit avec les artères, et ne comportent qu’une seule couche endothéliale, rendant possible la formation de FAVD à ce niveau.
– FAVD et thrombose veineuse : cette association est fréquemment retrouvée dans la littérature, mais décrite de façon controversée (46,56,70). Certains auteurs ont démontré l’apparition de novo d’une FAVD du sinus latéral chez des patients, dans les suites d’une thrombose de ce même sinus. D’autres auteurs au contraire pensent que les modifications hémodynamiques entrainées par l’apparition de la FAVD sont responsables de la thrombose éventuelle des sinus.
Dans les deux hypothèses, les mécanismes restent peu clairs, et font appel aux microshunts préexistants (cf. plus haut), eux-mêmes parfois contestés.
– FAVD et traumatisme crânien : l’association fréquente des traumatismes crâniens avec les thromboses des sinus veineux (70,16) est considérée comme probablement significative dans le développement ou l’apparition de FAVD (15,21,30).
– Immunohistochimie : des facteurs de croissance vasculaire comme le VEGF (vascular endothelial growth factor) et l’ephrin-B2 ont été impliqués. La FAVD ou une thrombose veineuse serait responsable d’une ischémie veineuse par hyper pression veineuse ; cela induirait une augmentation locale du taux de VEGF qui favoriserait ou provoquerait le développement d’une FAVD (35,37,46,56,59,60,66,67).
Diagnostic
1/Symptomatologie clinique
Le pic de fréquence des manifestations cliniques se situe au cours de la 5ème décennie, avec une petite prédominance féminine (55%) (16,36).
L’inversion du flux veineux et l’augmentation de pression veineuse rendent compte des signes cliniques. Parfois, une partie de la symptomatologie est due à des phénomènes associés de thrombose veineuse (cf. plus haut). Les signes cliniques sont très variables selon qu’il s’agit de signes au cours des hémorragies, ou en dehors de l’hémorragie (8,16,36). Ensuite ils varient selon la localisation et selon le type de la FAVD (4, 17).
– Acouphènes pulsatiles : le plus fréquent des symptômes cliniques (67%des cas). Souvent homolatéral à la FAVD, rétro-mastoïdien, présent dans les FAVD intéressant les sinus transverse, sigmoïde ou pétreux supérieur, son intensité ne dépend pas de la taille ou du débit de la FAVD. Il est souvent source d’anxiété et d’insomnie, et très souvent audible à l’auscultation du crâne (21,43,50). Il peut être méconnu chez un enfant qui l’aura toujours entendu et ne le signalera pas comme un symptôme anormal. Il peut être modifié, atténué ou supprimé transitoirement par des manœuvres de compression externe des artères afférentes. Enfin, une modification ou même sa disparition spontanée justifie la réalisation d’un examen angiographique de contrôle car elle n’est pas synonyme de thrombose spontanée avec guérison de la FAVD, mais de modifications hémodynamiques ou angioarchitecturales, donc d’une modification du risque hémorragique de la FAVD.
– Hémorragies : il s’agit de la plus redoutée des manifestations cliniques. Elles surviennent dans 20 à 23% des cas (4, 16, 21). Son risque de survenue dépend de la localisation et surtout du type de la FAVD (4,12,44). Les FAVD à drainage veineux cortical auraient un risque de rupture très supérieur (20 fois supérieur) à celui des FAVD se drainant seulement dans des sinus. Le risque annuel de saignement annuel est estimé à 2% par an (12), avec un taux de resaignement estimé entre 20 et 50% (19). Il s’agit d’hémorragies intraparenchymateuses, intraventriculaires, sous arachnoïdiennes, ou sous durales ; elles peuvent être à distance du nidus de la FAVD. Il est impossible de retrouver dans la littérature des taux de mortalité ou des indices de gravité de ces hémorragies dont la symptomatologie peut en tout cas aller de la céphalée brutale et isolée au coma avec déficit neurologique. Lorsque le volume de l’hématome ne rend pas compte de la gravité de la clinique, il faut suspecter une thrombose veineuse associée.
– Exophtalmie pulsatile et atteintes visuelles : essentiellement pour des FAVD injectées par des artères méningées des parois du sinus caverneux qui se drainent dans le sinus caverneux, entraînant une hyperpression dans le sinus(16,12,21). Il se produit alors une exophtalmie pulsatile avec une hyperhémie conjonctivale et un dysfonctionnement des autres nerfs crânien traversant le sinus ou ses parois. En l’absence de traitement efficace de la FAVD, il existe un risque réel de perte de l’œil ou de la vision de l’œil atteint. Il peut s’agir d’une urgence thérapeutique relative.
– Céphalées : en dehors des hémorragies et de l’hypertension intracrânienne (HIC), elles sont fréquentes (50 à 63% des cas), et seraient expliquées par la distension des sinus duraux ou par des remaniements inflammatoires des parois de ces sinus, ou par des phénomènes thrombotiques (16, 21,43). Peu spécifiques, elles augmentent à l’effort, au changement de position et à la manœuvre de Valsalva.
– Hydrocéphalie : peu fréquente. Elle peut s’expliquer par des troubles de résorption du LCS en raison de l’hyperpression veineuse, par des épisodes itératifs d’HSA, voire par une compression de l’aqueduc de Sylvius par une veine de Galien dilatée (4,12,16,21,31).
– Démence : dans 12% des cas. Il s’agirait d’une encéphalopathie veineuse congestive. Des observations de guérison après traitement de la FAVD ont été rapportées. Dans ces cas, des anomalies de signal de la substance blanche en IRM T2 étaient présentes avant le traitement de la FAVD (21, 31,50,51).
– Hypertension intracrânienne : réalisant parfois des tableaux cliniques de « pseudo tumor cerebri », à différencier des HIC dites bénignes (16,21).
– Epilepsie : des crises partielles ou généralisées sont observées dans 3 à 15 % des cas, secondaires à une complication hémorragique, ou à une irritation corticale par une ectasie veineuse (16,21).
– Paralysie des nerfs crâniens : soit par phénomène de vol vasculaire aux dépends des artères afférentes des nerfs crâniens (vascularisés souvent par des branches méningées), soit compression directe par des dilatations veineuses (10,16,21,43,47).
– Myélopathie progressive : lorsque la FAVD intracrânienne emprunte un drainage veineux péri-médullaire. Cette présentation clinique représente environ 3 % des cas (16). L’évolution est semblable à celle des FAVD rachidiennes : caudo-crâniale, elle débute par un syndrome du cône terminal et de la queue de cheval, sensitivo-moteur avec des troubles génito-sphinctériens (22). Initialement les symptômes sont réversibles (Congestion veineuse du cône terminal), puis irréversible (infarctus veineux). En l’absence de traitement, l’évolution se fait vers une tétraplégie définitive (53).
– Asymptomatique : de découverte fortuite, ou au cours d’un bilan neuroradiologique dans le cadre d’un traumatisme crânien ou d’une thrombophlébite cérébrale (4, 12, 62, 65).
Au total, les signes cliniques sont divers et polymorphes, mais ceci est le résultat de l’hétérogénéité des types de FAVD et de leurs localisations possibles. D’où l’intérêt des classifications proposées (cf. plus bas).
2/ Eléments d’imagerie
a/ Dans le contexte d’une hémorragie récente ou de l’urgence
– Le diagnostic de l’hémorragie repose sur le scanner sans injection de produit de contraste ; cet examen est alors complété immédiatement par un angioscanner avec des temps veineux et artériels. Cet examen montre essentiellement les veines de drainage de la FAVD, et beaucoup moins bien les afférences artérielles. Dans le cas d’une FAVD de type III ou IV, si l’origine de la veine de drainage peut être identifiée, il peut être utile de réaliser le scanner selon un protocole utilisable en neuronavigation (12,24,43,50).
– Dans ce contexte d’urgence l’IRM a une place très restreinte.
– Si le degré d’urgence le permet, et selon la complexité estimée de la FAVD, une angiographie digitalisée sera le plus souvent réalisée en complément (24,43).
b/ En dehors de l’urgence
– L’angioscanner garde un intérêt pour évaluer de façon non invasive la FAVD, au moins son type et sa localisation, mais sera à compléter dans tous les cas où il persiste un doute diagnostic (rôle de la FAVD dans les symptômes présentés par le patient par exemple), et dans tous les cas où un traitement curatif est envisagé.
– L’IRM est le meilleur examen de départ, permettant d’évaluer l’état du parenchyme, d’éliminer d’autres causes éventuelles à l’origine de la symptomatologie clinique, de retrouver les stigmates d’éventuelles hémorragies antérieures, de mettre en évidence par des séquences d’angioMR la FAVD, et l’état des sinus veineux (thrombophlébite associée ?)(43). C’est sur cet examen que la majorité des FAVD non symptomatiques, ou de découverte fortuite sont mises en évidence (3,16,50,62). Il reste insuffisant pour préciser les modalités thérapeutiques, notamment endovasculaires.
– L’angiographie digitalisée est l’examen radiologique de référence, à la fois morphologique et hémodynamique (3,16,24,50,62). L’examen explore les territoires carotidiens internes et externes des deux côtés, ainsi que les deux artères vertébrales, avec des incidences multiples, des clichés avec soustraction afin d’identifier précisément le point de shunt et l’origine du drainage veineux, mais aussi clichés avec les repères osseux, et reconstructions 3D de façon à obtenir une localisation anatomique précise. Des injections sélectives par pédicule afférent sont réalisées, et le drainage veineux est documenté de façon détaillée. Cet examen doit permettre de déterminer le type et le risque théorique représenté par la FAVD, d’analyser les possibilités de traitement endovasculaire par voie artérielle ou veineuse, et d’évaluer les possibilités chirurgicales en identifiant et en localisant précisément le point de shunt et l’origine de la veine de drainage (12,43,50).
– Actuellement, les progrès dans les appareils d’imagerie permettent de réaliser des angioscanners ou des angioMR dynamiques, dits angioscanner 4D ou angioMR 4D où la différenciation entre artères et veines peut être faite. Ces nouveaux examens sont de plus en plus utilisés dans le cadre de l’imagerie diagnostique.
Moyens de caractériser le diagnostic : classifications
Plusieurs classifications ont été proposées.
– classification d’Aminoff , selon la localisation du sinus veineux (1) : on distingue un groupe antéro-inférieur (sinus caverneux, pétreux supérieur et inférieur et sphéno-pariétal), et un groupe postéro-supérieur (sinus sagittal supérieur et inférieur, droit, transverse, latéral, et sigmoïde). Mais cette classification aboutit à 2 très grands groupes hétérogènes sans signification clinique utilisable. D’autres auteurs (4,36) utilisent une classification anatomique plus détaillée faisant de chaque localisation décrite une entité anatomo-clinique. Cependant ces classifications ne peuvent rendre compte que des FAVD empruntant un sinus veineux.
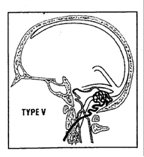
– classification de Cognard et Merland, selon le type de drainage veineux (16). Il s’agit d’une révision de la classification de Djindjian et Merland (1978) ; elle fait actuellement référence car elle permet d’évaluer le risque que comporte l’histoire naturelle de cette pathologie (Figure 1).
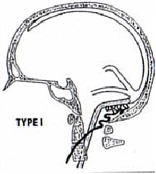
- Type I : sinus veineux en iso-courant (41%)
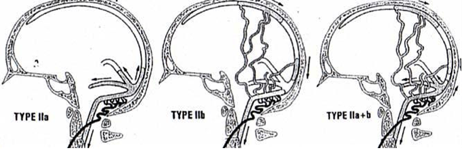
- Type II : sinus veineux avec flux rétrograde
- IIa : reflux dans l’amont du sinus, ou dans d’autres sinus (13%)
- IIb : reflux dans des veines corticales par l’intermédiaire d’un sinus (5%)
- IIa+b : reflux dans un ou plusieurs sinus et dans des veines corticales (9%)
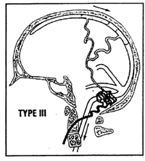
- Type III : drainage direct dans une ou plusieurs veines corticales non ectasiques (12%)
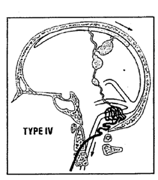
- Type IV : drainage direct dans une ou plusieurs veines corticales ectasiques (>5mm de diamètre ou 3Xdiamètre de la veine) (14%)
- Type V : drainage direct dans les veines périmédullaires (6%)
– classification de Borden (1995) simplifie la classification précédente (11), garde sa valeur prédictive du risque présenté par la FAVD, et permet de regrouper les FAVD intracrâniennes et spinales :
- Type I : drainage dans un sinus veineux ou dans une veine méningée en iso-courant
- Type II : drainage dans un sinus veineux avec reflux dans une veine leptoméningée
- Type III : drainage direct dans une veine leptoméningée, corticale ou spinale
– classification de Barrow (1985) dédiée aux fistules artérioveineuses du sinus caverneux (7) :
- Type A : fistule directe entre l’artère carotide interne (dans sa portion intra-caverneuse) et le sinus caverneux
- Type B : fistule alimentée par des branches méningées de la carotide interne et se drainant dans le sinus caverneux
- Type C : fistule alimentée par des branches méningées de la carotide externe et se drainant dans le sinus caverneux
- Type D : fistule alimentée par des branches méningées des carotides internes et externes et se drainant dans le sinus caverneux.
En fait le type A ne correspond pas à une FAVD, il s’agit d’une fistule directe, non durale, secondaire à un traumatisme crânien à haute énergie cinétique (ou exceptionnellement à la rupture d’un anévrysme carotidien intra-caverneux).
Au total, les signes cliniques sont divers et polymorphes, mais ceci est le résultat de l’hétérogénéité des types de FAVD et de leurs localisations possibles. Si on tient compte des types de FAVD selon Merland et Cognard (16,36,39) :
– type I : asymptomatiques, ou révélées par des acouphènes pulsatiles, parfois avec des céphalées, sans risque hémorragique. En général localisées au sinus transverse ou à cette région.
– type IIa : avec une HIC dans 37 % des cas, sans risque hémorragique significatif.
– type IIb : apparition d’hémorragies dans 10 % des cas.
– type IIa+b : 53 % des cas présentent une HIC, une hémorragie, un déficit neurologique ou des crises comitiales.
– type III : 76 % des cas présentent un symptôme grave ou menaçant, et dans 33 % des cas, une hémorragie.
– type IV : 97 % des patients présentent un symptôme grave, et 70 % une hémorragie.
– type V : 50 % des patients présentent une myélopathie progressive
– à part, les FAVD du sinus caverneux (de type I à IIa+b), avec des complications ophtalmologiques spécifiques à leur localisation et un risque hémorragique croissant lorsqu’elles sont de type IIb ou plus (69).
Traitement
Il a pour but de fermer le shunt totalement et définitivement. L’angioarchitecture des FAVD permet de comprendre que l’occlusion d’une FAVD peut être obtenue soit par un abord artériel nécessitant la fermeture de toutes les artérioles afférentes, soit par la fermeture du collecteur veineux à son origine, mettant en hyperpression temporaire le nidus intradural (donc sans risque de rupture intracrânienne) et aboutissant à une thrombose rétrograde du nidus et des artérioles afférentes (8,13,23,28,34,70,72)
Dans les deux cas, voie artérielle ou voie veineuse, l’occlusion doit être la plus proximale possible par rapport au point de shunt, au risque de voir se développer des récidives en cas d’occlusion artérielle incomplète (avec obstruction d’une voie d’accès endovasculaire à la FAVD), ou des infarctus veineux en cas d’occlusion veineuse distale et non sélective.
Moyens thérapeutiques
Il existe 3 moyens thérapeutiques efficaces qui peuvent être utilisés isolément ou en association : la chirurgie , la radiochirurgie, les traitements endovasculaires.Toutefois leur combinaison et leur mise en route doit être discutée auparavant car certains gestes peuvent compromettre les suivants (6,8,13,29,41,49,52). Ainsi la chirurgie peut fermer des voies d’accès endovasculaires, l’embolisation imposer une anticoagulation contrindiquant un geste chirurgical, les deux dernières techniques peuvent transformer une cible simple de radiothérapie en un réseau anastomotique complexe non cathétérisable, non accessible à la radiothérapie, et source de grosses difficultés chirurgicales. Ceci souligne l’importance d’une concertation multidisciplinaire pour la prise en charge des FAVD : systématiquement en l’absence d’urgence, mais de préférence également en situation d’urgence.
– La chirurgie
Le principe de la chirurgie est simple et efficace dans les FAVD qui n’empruntent pas de sinus veineux (FAVD de types III, IV et V de Merland et Cognard, ou de type III de Borden) (32, 52, 63). Il consiste à occlure l’origine de la veine de drainage, au ras de son origine à la face profonde de la dure-mère. Ceci entraine une thrombose rétrograde de la FAVD.
Pour les FAVD empruntant un sinus veineux (FAVD de types I et IIa, IIb, IIa+b de Merland et Cognard, ou de types I et II de Borden), les collecteurs veineux ne peuvent en général pas être occlus complètement sans risques pour le drainage veineux encéphalique, et ils ne sont pas tous aisément accessibles. L’occlusion complète par le versant artériel ne présente pas de risque théorique mais par contre sa réalisation (squelettisation et isolement du sinus) en est difficile, laborieuse et hémorragique, avec de nombreux traitements incomplets (13,20,29,32,52,). Ceci est également vrai pour tous les types de FAVD du sinus caverneux (7,69).
La chirurgie peut aussi être envisagée en combinaison avec le traitement endovasculaire ou en complément de ce dernier. Elle peut parfois consister à exposer un sinus dural de façon à y introduire directement un cathéter pour embolisation ultérieure dans des situations (de plus en plus rares) ou le cathétérisme habituel à distance est impossible (13,29,41,49,52).
– La radiochirurgie :ou radiothérapie stéréotaxique non fractionnée a l’avantage d’être peu invasive, mais outre sa relativement faible disponibilité actuelle, elle a l’inconvénient d’un délai d’action de long, ce qui n’est pas adapté à de nombreuses situations cliniques. Il s’agit du seul type de radiothérapie validé dans le traitement des FAVD. Une étude de Soderman (61) rapporte un taux de guérison par gamma knife de 68% avec deux ans de recul avec une dose de 22 Gy, et seulement 6% de complications. Ces résultats sont retrouvés ultérieurement par Pan et al. (48, 49)
– Les traitements endovasculaires sont réalisés sous anesthésie générale, et nécessitent parfois une anticoagulation efficace par héparine en fin de procédure en cas de baisse importante du débit sanguin dans un secteur veineux.
La voie artérielle est la plus souvent utilisée, en naviguant dans des branches de la carotide externe (54) : les microcathéters permettent un accès très proximal par rapport à la FAVD, souvent même intra-fistuleux, et seuls les passages trans-osseux représentent un obstacle réel au cathétérisme. La voie veineuse ne s’adresse qu’aux FAVD de type I et II de Borden et permet d’ occlure par cathétérisme veineux rétrograde, le sinus dans lequel se draine la FAVD ; ceci n’est envisageable que si le sinus ne draine pas le parenchyme cérébral (sauf à contre-courant, par reflux) ; enfin, en cas de thrombophlébite partielle associée, il est possible de traverser par un sinus thrombosé pour accéder à la FAVD (par exemple traverser un sinus pétreux inférieur thrombosé ou une veine faciale pour accéder à une FAVD du sinus caverneux) (2,65, 58, 64,5,34,9,72).
– L’abstention : représente parfois une attitude raisonnable, parfois la seule ; soit en cas de FAVD non ou peu symptomatique, soit en cas de FAVD complexe (types II de Merland et Cognard) à risque thérapeutique élevé et à probabilité de guérison faible (1,57,62).
Résultats du traitement
Les résultats sont difficiles à connaître précisément, dépendant des opérateurs, du type de FAVD et des méthodes de traitement, éventuellement combinées et itératives. Schématiquement :
– les méthodes endovasculaires permettent une guérison angiographique allant de 60 à 80% des cas, selon le type de FAVD (25,26,34,40,43) ;
– la chirurgie est actuellement réalisée dans les FAVD de type III et IV de Merland et Cognard : elle permet une occlusion complète dans plus de 90 % des cas (8,12,19,20,40,49,52)
– la radiochirurgie permet une occlusion complète dans 68 % des cas environ avec 2 ans de recul (48,52,61)
Indications et conduite à tenir
Les indications thérapeutiques dépendent essentiellement du risque hémorragique de la FAVD, de l’existence d’une symptomatologie clinique grave, et du type de la FAVD qui conditionne la technique de traitement.
– FAVD sans reflux cortical, se drainant uniquement dans un sinus dural : il n’y a pas de risque hémorragique, l’approche chirurgicale est risquée, invasive et à forte probabilité de résultat incomplet. C’est la voie endovasculaire qui doit être proposée, si la symptomatologie le justifie.
– FAVD avec reflux cortical : il existe un risque hémorragique et un risque vital et fonctionnel sévère et le traitement de la FAVD est indiqué. Si le drainage se fait directement dans une veine corticale sans emprunter de sinus veineux, la chirurgie peut parfaitement être proposée, soit en première intention, notamment en cas d’hématome associé, soit après une tentative endovasculaire ; mais l’indication d’occlure la FAVD est formelle et la chirurgie efficace et relativement aisée. Si le drainage veineux se fait par un sinus veineux avec reflux cortical, l’indication de traiter la FAVD reste formelle, mais la voie endovasculaire est à privilégier et reste souvent la seule technique raisonnable ; la chirurgie ou la radiochirurgie peuvent apporter une aide secondaire mais ne constituent pas l’essentiel du traitement.
Conclusions
Les FAVD sont pour leur majorité prises en charge par les neuroradiologues, mais les neurochirurgiens ne doivent pas les ignorer, car les FAVD les plus graves et les plus risquées sont celles qui sont les plus aisées à opérer : en face d’une FAVD de type III ou IV de Merland et Cognard, l’indication de traiter et d’éradiquer est très forte, et il faut savoir préférer un geste chirurgical simple, radical et d’efficacité immédiate à un traitement endovasculaire hasardeux et incomplet.
L’analyse du dossier radiologique doit se faire en collaboration avec les neuroradiologues car l’identification et la localisation précise de la FAVD est souvent difficile.
Les classifications des FAVD sont utiles et pertinentes car elles sont directement liées au risque de l’histoire naturelle de la FAVD, et aux difficultés thérapeutiques ; on peut résumer ainsi ces classifications :
– drainage dans une veine corticale : risque vital si il existe un tel drainage, risque purement fonctionnel dans le cas contraire
– drainage par l’intermédiaire d’un sinus veineux : traitement endovasculaire à privilégier dans ces cas, la chirurgie devenant risquée et difficile (sauf en complément éventuel) ; par contre en l’absence d’un tel drainage (types III et IV de Merland et Cognard), la chirurgie est facile et efficace.
Il faut enfin souligner l’absolue nécessité d’une collaboration étroite entre les équipes de neurochirurgie et de neuroradiologie diagnostique et interventionnelle.
++++
BIBLIOGRAPHIE
- Aminoff M.J. Vascular anomalies of the intracranial dura mater. Brain 1973 ;96 :601-612
- Andreou A., Ioannidis I., Psomas M. Transvenous embolization of a dural carotid-cavernous fistula through the contralateral superior petrosal sinus. Neuroradiology 2007 ;49(3):p.259-63
- Arnautovic KI, Krisht AF. Transverse-sigmoid sinus dural arteriovenous malformations. Contemp Neurosurg , 2000 ;21:15p1-6
- Awad I.A., Little J.R., Akrawi W.P., AHL J. Intracranial dural arteriovenous malformations : factors predisposing to an aggressive neurological course. J Neurosurg 72:839-850, 1990
- Baldauf J. et al. Embolization of indirect carotid-cavernous fistulas using the superior ophthalmic vein approach. Acta Neurol Scand, 2004 ;110(3) : p.200-4
- Barnwell S.L., Halbach V.V., Higashida R.T. et al. Complex dural arteriovenous fistulas : results of combined endovascular and neurosurgical treatment in 16 patients. J Neurosurg 1989 ;71:352-8
- Barrow D.L., Sector R.H., Braun I.F., Landman J.A., TindalS.C., Tindal G.T. Classification and treatment of spontaneous carotid cavernous fistulas. J Neurosurg 1985 ;62:248-256.
- Bawinski G.et al. Evolution of different therapeutic strategies in the treatment of cranial dural arteriovenous fistulas : report of 30 cases. Acta Neurochir (Wien), 1996 ;138(2):132-8
- Biondi A. et al. Cavernous sinus dural fistulae treated by transcavernous approach through the facial vein : report of seven cases and review of the literature. AJNR Am J Neuroradiol, 2003 ;24(6):p1240-6
- Blomquist M.H., Barr J.D., Hurst R.W. Isolated unilateral hypoglossal neuropathy caused by dural arteriovenous fistula. AJNR Am J Neuroradiol, 1998 ;19(5):p951-3
- Borden J.A., Wu K.W., Shucart W.A. A proposed classification for spinal and cranial dural arteriovenous fistulous malformations and implications for treatment. J Neurosurg 1995 ;82:166-179,
- Brown R.D., et al. Natural history, evaluation and management of intracranial vascular malformations. Mayo Clin Proc, 2005 ;80(2), p269-81
- Caire F., Chapot R., Moreau J.J. Venous embolization of dural arteriovenous fistulas. Transcranial approach under neuronavigation. Neurochirurgie, 2006 ;52(6):p520-4
- Castaigne P, Bories J, Brunet P. Les fistules artérioveineuses méningées pures à drainage veineux cortical. Rev Neurol (Paris) 1976 ;132:169-181
- Chaundhary M.Y., et al. Dural arteriovenous malformations of the major venous sinuses : an acquired lesion. AJNR Am J Neuroradiol 1982 ;3(1):p13-9
- Cognard C., Gobin Y.P., Pierot L., et al. Cerebral dural arteriovenous fistulas : clinical and angiographic correlation with a revised classification of venous drainage. Radiology 1995 ;194 (3):671-80
- Convers P. et al. Dural arteriovenous fistulas of the posterior fossa and thrombosis of the lateral sinus. Discussion of their relations and treatment a propos of 2 cases. Neurochirurgie, 1986 ;32(6):p495-500
- Djindjian R, Merland JJ. Superselective arteriography of the external carotid artery. New York : Springer-Verlag, 1978
- Duffau H., Lopes M., Janosevic V., Sichez J.P., Faillot T., Capelle L., Arthuis F., Fohanno D. Early rebleeding from intracranial dural arteriovenous fistulas :report of 20 cases and review of the literature. J Neurosurg 1999 ;90:78-84
- Finn M., Klimo P., Couldwell W.T. Interpositional dural graft technique for the treatment of dural arteriovenous fistulas. Neurosurg Focus, 2007 ;22(3):pE10 ; discussion Editorial
- Gaston A. et al. Dural arteriovenous fistulae. J Neuradiol, 1988. 15(2) :p160-185
- Gobin Y.P. et al. Endovascular treatment of intracranial dural arteriovenous fistulas with spinal perimedullary venous drainage. J Neurosurg 1992 ;77(5):p718-23
- Gobin Y.P., Houdart E., Rogopoulos A., Casasco A., Bailly A.L., Merland J.J. Percutaneous transvenous embolization through the thrombosed sinus in transverse sinus dural fistula. AJNR Am J Neuroradiol 1993 ;14:1102-1105
- Graeb D.A., Dolman C.L. Radiological and pathological aspects of dural arteriovenous fistulas. J Neurosurg 1986 ;64:962-7
- Halbach V.V., Higashida R.T., Hieshima G.B., Hardin C.W., Pribam H. Transvenous embolization of dural fistulas involving the cavernous sinus. AJNR Am J Neuroradiol 1998 ;10:377-384,
- Halbach V.V., Higashida R.T., Hieshima G.B., Mehringer C.M., Hardin C.W. Transvenous embolization of dural fistulas involving the transverse and sigmoid sinuses. AJNR Am J Neuroradiol , 1998 ;10:385-393
- Halbach V.V., Higashida R.T., Hieshima G.B., Reicher M., Norman D., Newton T.H. Dural fistulas involving the cavernous sinus : results of treatment in 30 patients. Radiology 1987 ;163:437-442
- Halbach V.V., Roy D., Raymond J. The role of transvenous embolization in the treatment of intracranial dural arteriovenous fistulas. Neurosurgery , 1997 ;40:1133-1141.
- Houdart E., Saint-Maurice J.P., Chapot R., Ditchfield A., Blanquet A., Lot G., Merland J.J. : Transcranial approach for venous embolization of dural arteriovenous fistulas. J Neurosurg , 2002:97:280-286
- Houser O.W., et al. Arteriovenous malformations affecting the transverse dural venous sinus : an acquired lesion. Mayo Clin Proc, 1979 ;54(10):p651-61
- Hurst R.W., Bagley L.J., Galetta S., Glosser G., Lieberman A.P., Sinson G., Stecker M., Zager E., Raps E.C., Flamm E.S. Dementia resulting from dural arteriovenous fistulas : the pathologic findings of venous hypertensive encephalopathy. AJNR Am J Neuroradiol, 1998 ;19(7):p1267-73
- Kakarla U.K., et al. Surgical treatment of high-risk intracranial dural arteriovenous fistulae : clinical outcomes and avoidance of complications. Neurosurgery 2007 ;61(3) : p447-57 ; discussion 457-9
- Kerber C.W., Newton T.H. The macro and microvasculature of the dura mater. Neuroradiology, 1973 ;6(4):175_9
- Klisch J., et al. Transvenous treatment of carotid cavernous and dural arteriovenous fistulae : results for 31 patients and review of the literature. Neurosurgery, 2003 ;53(4):p836-56 ; discussion 856-7
- Kojima T., et al. The relationship between venous hypertension and expression of vascular endothelial growth factor : hemodynamic and immunohistochemical examinations in a rat venous hypertension model. Surg Neurol, 2007 ;68(3):p277-84 ; discussion 284
- Lasjaunias P., Chiu M., Brugge K., Tolia A., Hurth M., Berenstein A. Neurological manifestations of dural arteriovenous malformations. J Neurosurg 1986 ;64:724-773
- Lawton M.T., Jacobowitz R., Spetzler R.F. Redefined role of angiogenesis in the pathogenesis of dural arteriovenous malformations. J Neurosurg , 1997 ;87:267-274
- Link M.J., Coffey R.J., Nichols D.A., Gorman D.A. The role of radiosurgery and particulate embolization in the treatment of dural arteriovenous fistulas. J Neurosurg , 1996 ;84:804-809
- Lucas C.P.L., Caldas J.G., Prandini M.N. Do leptomeningeal venous drainage and dysplastic venous dilation predict hemorrhage in dural arteriovenous fistulas ? Surg Neurol, 2006 ;66 Suppl 3 : S 2-5 ; discussion S5-6
- Lucas C.P.L., Zabramsk J.M., Spetzler R.F., Jacobowitz R. Treatment of intracranial dural arteriovenous malformations : a meta-analysis from the English language literature. Neurosurgery , 1997 ;40:1119-1132
- Luo C.B., et al. Transcranial embolization of a transverse-sigmoid sinus dural arteriovenous fistula carried out through a décompressives craniotomy. Acta Neurochir (Wien), 2007 ;149(2):p197-200 ; discussion 200
- Maillot C., Kehrli P. Arterial vasculature of the dura mater of the anterior cranial fossa. J Neuradiol, 1997 ;24(4):p251-69
- Malek A.M., et al. Diagnosis and treatment of dural arteriovenous fistulas. Neuroimaging Clin N Am, 1998 ;8(2):p445-68
- Nakamura M., et al. Two unusual cases of multiple dural arteriovenous fistulas. Neurosurgery, 1997 ;41(1):p288-92 ; discussion 292-3
- Newton TH, Cronqvist S. Involvement of dural arteries in intracranial arteriovenous malformations. Radiology 1969 ;93 :1071-1078
- Nishijima M., et al. Etiological evaluation of dural arteriovenous malformations of the lateral and sigmoid sinuses based on histopathological examinations. J Neurosurg, 1992 ;76(4):p600-6
- Ott D., Bien S., Krasznai L. Embolization of a tentorial dural arteriovenous fistula presenting as typical trigeminal neuralgia. Headache, 1993 ;33(9):p503-8
- Pan D.H., et al. Stereotactic radiosurgery for the treatment of dural arteriovenous fistulas involving the transverse-sigmoid sinus. J Neurosurg, 2002 ;96(5):p823-9
- Pan H.C., et al. Multidisciplinary treatment of cavernous sinus dural arteriovenous fistulae with radiosurgery and embolization. J Clin Neurosci, 2005 ;12(7):p744-9
- Panasci D.J., Nelson P.K. MR imaging and MR angiography in the diagnosis of dural arteriovenous fistulas. Magn Reson Imaging Clin N Am, 1995 ;3(3):p493-508
- Pierot L., et al. Combined neurosurgical and Neuroradiological treatment of a complex superior sagittal sinus dural fistula. Neurosurgery, 1998 ;42(1):p194-7
- Rath S.A., Derakshani S. Concepts of combined endovascular and surgical treatment for dural arteriovenous fistulae : concepts derived from experience in treating three unusual lesions. Acta Neurochir (Wien), 2004 ;146(3) : p229-35 ; discussion 235
- Renner C, Helm J, Roth H, Meixensberger J : Intracranial dural arteriovenous fistula associated with progressive cervical myelopathy and normal venous drainage of the thoracolumbar cord : case report and review of the literature. Surg Neurol 2006 ;65:506-10
- Rey A., et al. Treatment of carotid-cavernous fistulae. Neurochirurgie 1973 ;19(1):p111-22
- Roland J., et al. Microvascularization of the intracranial dura mater. Surg Radiol Anat, 1987 ;9(1):p43-9
- Sakaki T., et al. Dural arteriovenous fistula of the posterior fossa developing after surgical occlusion of the sigmoid sinus : report of five cases. J Neurosurg, 1996 ;84(1):p113-8
- Satomi J, van Dijk JMC, TerBrugge KG, Willinsky RA, Wallace C. Benign cranial dural arteriovenous fistulas : outcome of conservative management based on the natural history of the lesion. J Neurosurg 2002 ;97 :767-70
- Shaibani A., et al. Primary treatment of an indirect carotid cavernous fistula by injection of N-butyl cyanoacrylate in the dural wall of the cavernous sinus. Surg Neurol, 2007 ;67(4):p403-8 ; discussion 408
- Shin Y., et al. Vascular endothelial growth factor expression in the rat dural arteriovenous fistula model. No To Shinkei, 2003 ;55(11):p946-52
- Shin Y., et al. Expression of angiogenic growth factor in the rat DAVF model. Neurol Res, 2007
- Söderman M. et al. Gamma knife surgery for dural arteriovenous shunts : 25 years of experience. J Neurosurg, 2006 ;104(6):p867-75
- Söderman M,Pavic L, Edner Goran, Holmin S, Anderson T :Natural history of dural arteriovenous shunts. Stroke 2008 ;39:1735-1739
- Sundt R., Piepgras D. The surgical approach to arteriovenous malformations of the lateral and sigmoid dural sinuses. J Neurosurg, 1983 ;59(1):p32-9
- Suzuki S., et al. Transvenous treatment of spontaneous dural carotid-cavernous fistulas using a combination of detachable coils and Onyx*. AJNR Am J Neuroradiol, 2006 ;27(6):p1346-9
- Theaudin M., et al. Diagnosis and treatment of dural carotid-cavernous fistulas : a consecutive series of 27 patients. J Neurol Neurosurg Psychiatry, 2007 ;78(2):p174-9
- Tirakotai W., et al. Immunohistochemical study in dural arteriovenous fistula and possible role of ephrin-B2 for development of dural arteriovenous fistulas. Chin Med J (Engl), 2004 ;117(12):p1815-20
- Tirakotai W., et al. Immunohistochemical study in dural arteriovenous fistula and possible role of local hypoxia in de novo formation of dural arteriovenous fistulas. Clin Neurol Neurosurg, 2005 ;107(6):p455-60
- Toulgoat F., et al. Transarterial embolization of intracranial dural arteriovenous malformations with ethylene vinyl alcohol copolymer (Onyx18*). J Neuroradiol, 2006 ;33(2):p105-14
- Turjman F., et al. Dural fistulae of the cavernous sinus treated by embolization. Ten cases. J Neuroradiol, 1992 ;19(4):p256-70
- Urtasun F., et al Cerebral dural arteriovenous fistulas : percutaneous transvenous embolization. Radiology, 1996 ;199(1):p209-17
- Willinsky R., et al. Tortuous engorged pial veins in intracranial dural arteriovenous fistulas : correlations with presentation, location, and MR findings in 122 patients. AJNR Am J Neuroradiol, 1999 ;20(6):p1031-6
- Yu S.C., et al. Transvenous embolization of dural carotid-cavernous fistulae with transfacial catheterization through the superior ophthalmic vein. Neurosurg, 2007 ;60(6):p1032-7 ; discussion 1037-8