2.2.4 Hémorragie sous-arachnoïdienne grave.
Moncef Berhouma, M.D., Ph.D., neurochirurgie, CHU Lyon, janvier 2021
Cas clinique progressif
Une patiente de 43 ans, sans antécédents notables, tabagique, arrive aux urgences suites à des céphalées brutales avec perte de connaissance de 3-4 minutes lors d’un effort physique.
Elle est inconsciente avec un GCS à 10/15 et une hémiparésie gauche. Les pupilles sont de tailles normales et réactives. Sa TA est à 190/110.
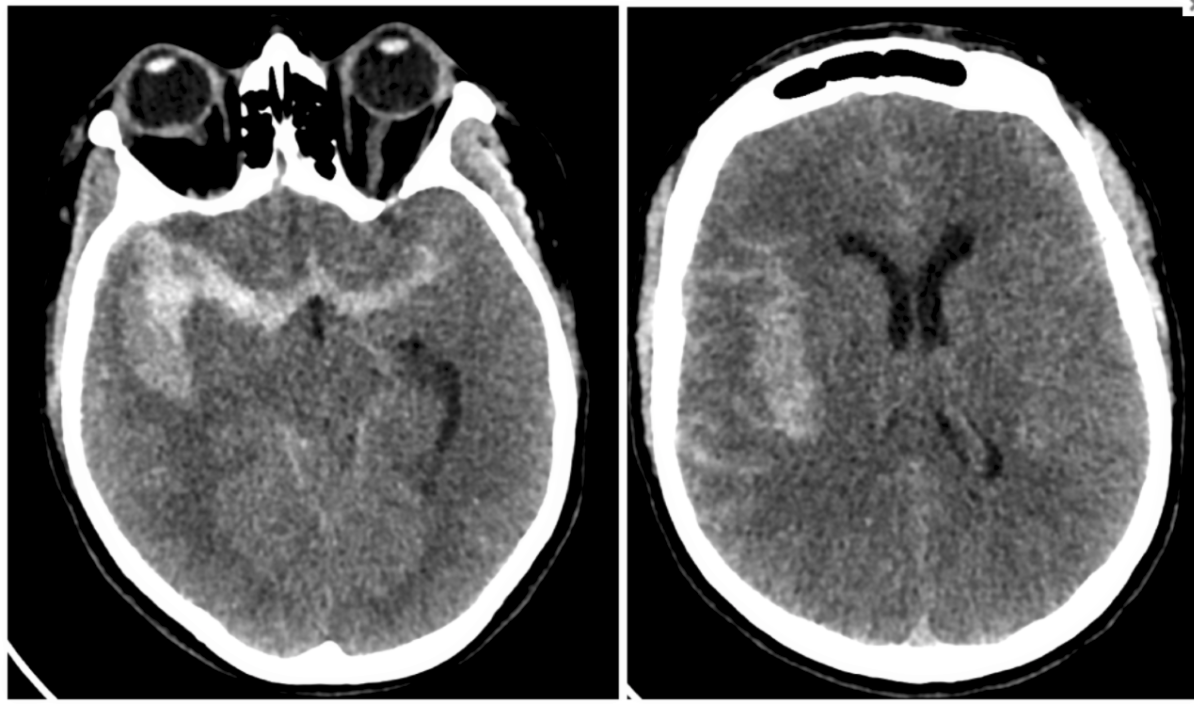
Vous établissez le diagnostic d’HSA au décours du scanner cérébral sans injection.
1 - Sur quels critères repose le caractère grave de cette HSA ?
2 – A l’admission en neuroréanimation, la patiente présente une anisocorie droite régressive en quelques minutes. Un capteur de PIC intraparenchymateux est mis en place après intubation de la patiente. On note une HTIC persistante malgré la sédation et les osmotiques. Un nouveau scanner cérébral est identique en dehors d’un effacement plus marqué des sillons corticaux. Quels sont les mécanismes de cette HTIC ?
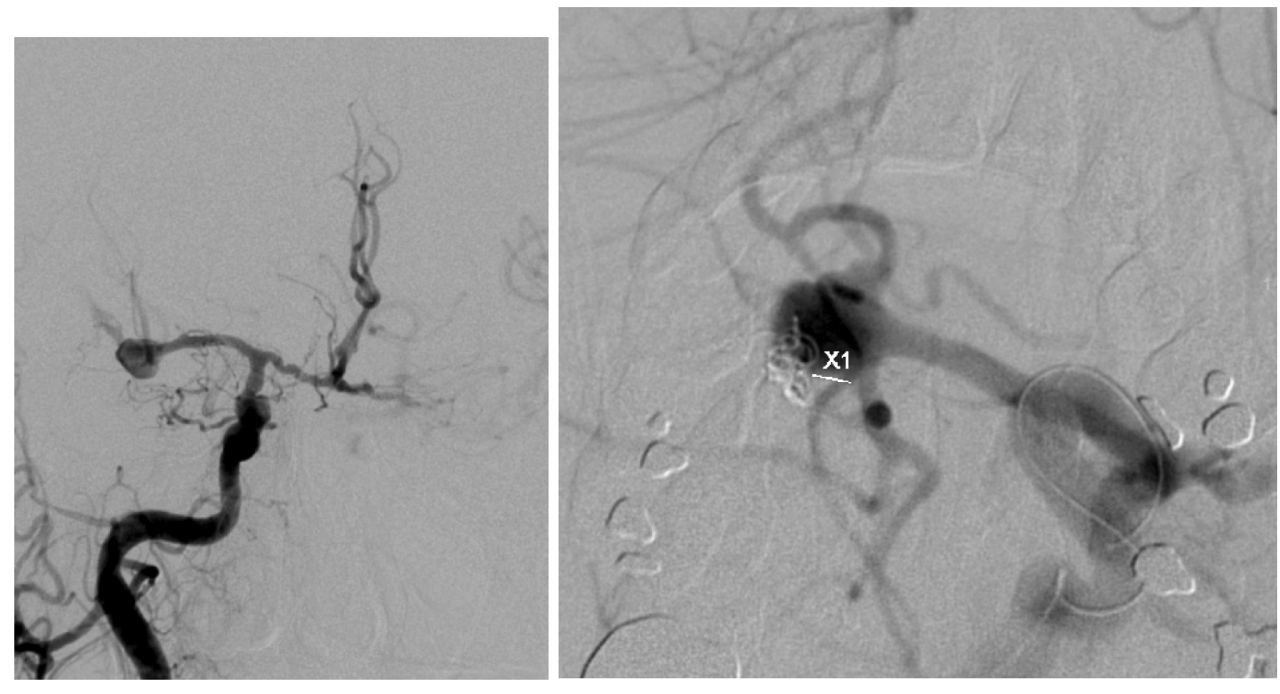
3- Une angiographie est réalisée en urgence. Elle révèle un anévrysme sylvien droit avec un saignement actif lors de l’examen. Sur la table d’angiographie, l’HTIC devient incontrôlable et l’anisocorie récidive. Quel est votre conduite à tenir ?
4 - Quel geste neurochirurgical proposez-vous dans cette situation ?
5 – En dehors de ce cas précis où l’HTIC a nécessité une décompression chirurgicale précoce, quel est habituellement le meilleur timing pour traiter (exclure) un anévrysme lors d’une HSA grave ?
6 – Au 2ème jour d’évolution, la patiente présente un état de choc hémodynamique, avec un scanner cérébral de contrôle inchangé (sans nouvelle complication cérébrale). Quelle est l’étiopathogénie la plus probable de cet état de choc ?
7 – La patiente émerge progressivement jusqu’à être extubée à J7. Elle est consciente avec une hémiparésie gauche. A J8 elle devient fébrile et somnolente. Son déficit moteur s’aggrave en quelques heures. Quelle complication peut expliquer cette dégradation ?
Memento didactique
Définition
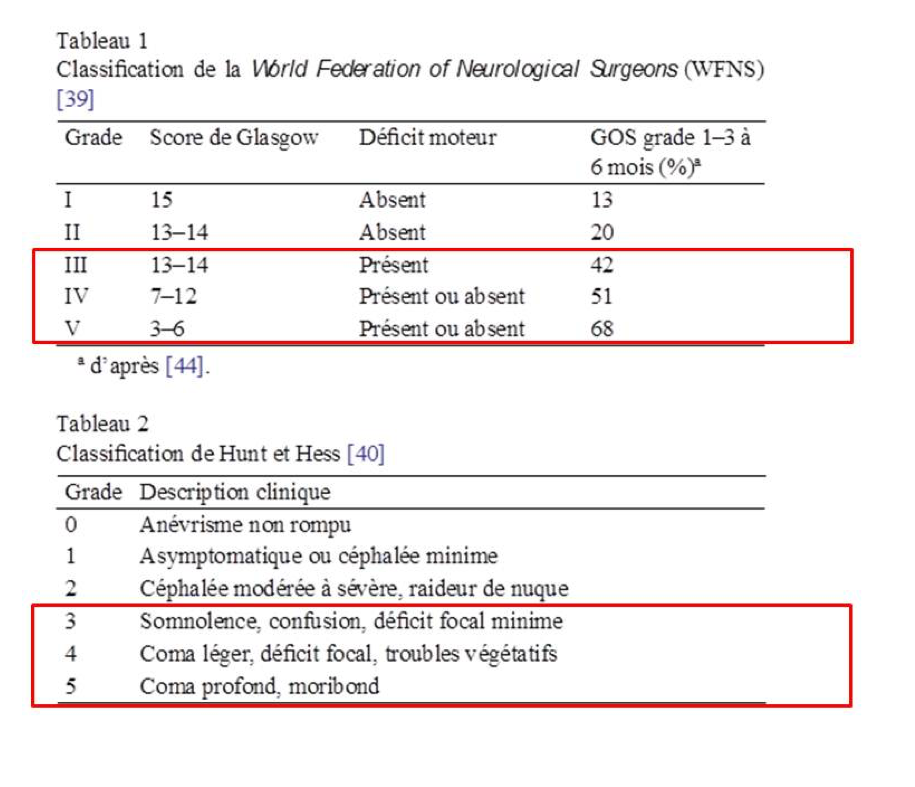
Les hémorragies sous-arachnoïdiennes (HSA) sévères correspondent aux grades III à V de la classification de la WFNS (ou 3 à 5 de la classification Hunt et Hess). Elles représentent environ 34% des HSA spontanées, et possèdent certaines spécificités notamment en termes de prise en charge, complications évolutives, morbidité et mortalité. [1]
Spécificités évolutives
Hypertension intracrânienne (HTIC)
Dans les HSA graves, l’HTIC est constante. Elle résulte de mécanismes différents parfois successifs voire concomitants durant les premiers jours d’évolution :
- Lors de la rupture anévrysmale liée à la quantité de sang faisant irruption dans les espaces sous-arachnoïdiens, les ventricules ou le parenchyme cérébral.[2]
- Œdème cérébral dans les heures qui suivent (facteurs prédictifs : perte de conscience initiale – dont la durée est également à valeur pronostique quant à l’ischémie ultérieure - et score de Hunt et Hess).[3]
- HTIC retardée à partir de J6 : diminution de la compliance cérébrale, augmentation des résistances à l’écoulement du LCR, ramollissement ischémique pseudo-tumoral
Hydrocéphalie
Une hydrocéphalie (quel que soit son timing, aigue, subaiguë ou chronique) complique 45 à 50 % des HSA graves contre 16 à 35% des HSA tous grades confondus. [4]
Vasospasme cérébral
Un vasospasme angiographique ou ultrasonographique est constant dans les HSA graves, avec une traduction ischémique clinique ou remnographique dans 40% des cas. Le vasospasme correspond à une réduction de la lumière de l’artère porteuse le plus souvent avec des anomalies de la microcirculation et des anomalies structurelles des parois vasculaires, apparaissant principalement entre le 5ème et le 14ème jour d’évolution. La traduction clinique correspond au déficit neurologique ischémique retardé. La physiopathologie est complexe et mal connue, impliquant essentiellement les produits de dégradation de l’hémoglobine. L’incidence du vasospasme clinique semble plus importante dans les HSA graves (proportionnel à la quantité de sang dans les citernes), en cas de tabagisme associé et en cas de survenue d’un choc cardiogénique. Le diagnostic suspecté cliniquement et au doppler transcrânien, est confirmé par l’angiographie cérébrale. Les imageries de perfusion TDM et IRM sont également utiles au diagnostic, alors que l’angiographie permet d’envisager un traitement en même temps (angioplastie, injection intra-artérielle de vasodilatateurs, …). Un traitement médical du vasospasme est toujours mis en place en parallèle reposant principalement sur le maintien d’une PAM élevée et la prévention des agressions cérébrales secondaires d’origine systémique (ACSOS).
Complications systémiques
L’incidence des complications systémiques (cardiaques, pulmonaires, métaboliques) semble plus élevée dans les HSA graves par rapport aux autres HSA. Un état de choc lié à une dysfonction myocardique ventriculaire gauche touche à peu près 13% des HSA graves, avec une incidence majeure des formes échographiques sans traduction clinique. [6] Le primum movens consiste en une stimulation hypothalamique à l’origine d’une hyperactivation sympathique et une décharge noradrénergique. [7] Il existe fréquemment des anomalies ECG associées à type de troubles du rythme très variés ou des anomalies de repolarisation. Lors d’une HSA grave, le dosage répété des marqueurs biologiques (CK-MB, BNP et troponine I) peut être utile. Rarement, cette atteinte cardiaque peut s’associer à un œdème pulmonaire neurogène aggravant le pronostic.
Spécificité de l’exclusion anévrysmale dans les HSA sévères
Une méta-analyse récente reprenant toutes les études sur les HSA graves comparant traitement précoce (moins de 24h) et traitement tardif ne retrouve pas de différence significative en termes de pronostic fonctionnel ni de mortalité, même si on retrouve une légère tendance à moins de resaignement pour le groupe traitement précoce. [5] Une exclusion anévrismale est généralement recommandée à la phase précoce dès que possible afin d’une part de réduire le risque de resaignement mais également de faciliter la gestion de la pression artérielle moyenne dans le cadre de la prévention du vasospasme.
Pronostic des HSA sévères
Dans les HSA graves par rupture d’un anévrisme sylvien, la présence d’un hématome intra-sylvien (au sein de la vallée sylvienne) ou d’une hydrocéphalie sont des facteurs de bon pronostic. [5]
Particulièrement dans les HSA graves, la survie moyenne est directement liée à l’âge du patient : 56.3±8 mois (patients de 60 à 69 ans), 31.6±7.6 mois (70–79 ans), et 7.6±5.8 mois (80–90 ans). [6]
Globalement malgré les progrès en termes d’exclusion endovasculaire ou microchirurgicale et surtout de neuroréanimation, le pronostic des HSA graves reste réservé : La mortalité globale avoisine les 60% avant versus 31% après traitement de l’anévrisme. Cependant 35-40% des patients conservent un pronostic fonctionnel correct. [7]
Points importants :
- L’HSA grave est définie par un grade WFNS supérieur ou égal à III, soit environ 1/3 de l’ensemble des HSA
- L’HTIC est constante et précoce dans les HSA graves, résultant de plusieurs phénomènes concomitants le plus souvent : hydrocéphalie, œdème cérébral, hématome intraparenchymateux ou cisternal sylvien éventuel, ischémie retardée pseudotumorale
- La sécurisation de l’anévrysme reste un temps essentiel mais son timing demeure discutable : L’exclusion précoce (J1) du sac ne modifie pas le pronostic fonctionnel ou la mortalité, même si elle semble réduire le risque de resaignement.
- Le vasospasme radiologique et ultrasonographique est quasiment constant à partir de la 1ère semaine, avec un risque d’ischémie retardée chez près de 40% des patients.
- Les complications systémiques sont très fréquentes : troubles ioniques majeurs (hyponatrémie), dysfonction myocardique et œdème pulmonaire, et thromboses veineuses profondes.
Réponses
1 - Un GCS à 10/15 et une hémiparésie gauche correspond à une HSA grade IV de la WFNS et donc à une HSA grave (WFNS III ou Hunt et Hess 3).
2 - Œdème cérébral (facteur prédictif dans ce cas : perte de connaissance lors de la présentation clinique)
3 - Après concertation multidisciplinaire rapide en salle d’artériographie, on décide d’un geste combiné NRI puis neurochirurgie du fait de l’HTIC menaçante. Le neuroradiologue parvient à arrêter l’hémorragie en cours par un seul coil en fond d’anévrysme au niveau de la phlyctène en quelques minutes, et ne tente pas de coiling plus complet pour ne pas perdre plus de temps et laisser le reste du sac et du collet mobilisables pour faciliter une chirurgie en urgence.
4 - Devant l’HTIC menaçante secondaire à l’œdème cérébral et à l’hématome cisternal sylvien, une craniectomie décompressive est réalisée avec clipping au collet et évacuation de l’hématome sylvien. Le geste comporte également une ventriculocisternostomie au niveau de la lame terminale. La PIC se normalise en fin d’intervention et l’anisocorie régresse.
5 – Dès que possible pour réduire le risque de resaignement
6 – Choc cardiogénique
7 - Vasospasme
Pour en savoir plus :
1- Conférence d’experts – Annales Françaises d’Anesthésie et de Réanimation (2005). https://sfar.org/hemorragie-sous-arachnoidienne-hsa-grave/
Cette conférence initiée par la Société française d’anesthésie et de réanimation (Sfar) a été réalisée en collaboration avec l’Association de neuroanesthésie réanimation de langue française (ANARLF), la Société française de neurochirurgie et la Société française de neuroradiologie.
2- De Oliveira Manoel et al. The critical care management of poor-grade subarachnoid hemorrhage. Critical Care (2016) 20:21
Article complet très didactique détaillant l’ensemble des complications des HAS graves du point de vue du neuroréanimateur.
Références
[1] Lanzino G, Kassell NF, Dorsch NW, Pasqualin A, Brandt L, Schmiedek P, et al. Double-blind, randomized, vehicle-controlled study of high-dose tirilazad mesylate in women with aneurysmal subarachnoid hemorrhage. Part I. A cooperative study in Europe, Australia, New Zealand, and South Africa. Journal of Neurosurgery 1999 ;90:1011–7. https://doi.org/10.3171/jns.1999.90.6.1011.
[2] Brinker T, Seifert V, Dietz H. Cerebral blood flow and intracranial pressure during experimental subarachnoid haemorrhage. Acta Neurochirurgica 1992 ;115:47–52. https://doi.org/10.1007/BF01400590.
[3] Claassen J, Carhuapoma JR, Kreiter KT, Du EY, Connolly ES, Mayer SA. Global cerebral edema after subarachnoid hemorrhage : frequency, predictors, and impact on outcome. Stroke 2002 ;33:1225–32. https://doi.org/10.1161/01.str.0000015624.29071.1f.
[4] Disney L, Weir B, Grace M. Factors influencing the outcome of aneurysm rupture in poor grade patients : a prospective series. Neurosurgery 1988 ;23:1–9. https://doi.org/10.1227/00006123-198807000-00001.
[5] Fukuda H, Hayashi K, Moriya T, Nakashita S, Lo BWY, Yamagata S. Intrasylvian hematoma caused by ruptured middle cerebral artery aneurysms predicts recovery from poor-grade subarachnoid hemorrhage. J Neurosurg 2015 ;123:686–92. https://doi.org/10.3171/2014.10.JNS141658.
[6] Goldberg J, Schoeni D, Mordasini P, Z’Graggen W, Gralla J, Raabe A, et al. Survival and Outcome After Poor-Grade Aneurysmal Subarachnoid Hemorrhage in Elderly Patients. Stroke 2018 ;49:2883–9. https://doi.org/10.1161/STROKEAHA.118.022869.
[7] de Oliveira Manoel AL, Mansur A, Silva GS, Germans MR, Jaja BNR, Kouzmina E, et al. Functional Outcome After Poor-Grade Subarachnoid Hemorrhage : A Single-Center Study and Systematic Literature Review. Neurocrit Care 2016 ;25:338–50. https://doi.org/10.1007/s12028-016-0305-3.