1.8.3 Conduite à tenir devant une infection postopératoire d’implants de stimulation cérébrale profonde
Marie Des Neiges SANTIN, M.D., CHU Strasbourg, Carine KARACHI, M.D., Ph.D., Hôpital Pitié Salpétrière AP-HP, Décembre 2021.
Questions
1)- Quelles sont les réponses justes concernant l’infection de matériel de SCP ?
a. c’est la complication postopératoire la plus fréquente de ce type de chirurgie.
b. le risque est maximal dans les 3 premiers mois post-opératoires.
c. le risque d’abcès cérébral est élevé.
d. le risque est plus important pour une chirurgie de remplacement de la pile (ou neurostimulateur) que pour une primo-implantation.
2)- Quel est la présentation clinique la plus fréquente ? (une réponse)
a. une fièvre.
b. un tableau neurologique aigu.
c. une cicatrice inflammatoire, une désunion ou un écoulement.
d. un tableau de méningite.
3)- Quelle est la prise en charge en première intention d’une infection au niveau du neurostimulateur (pile) ? (une réponse)
a. introduction d’une antibiothérapie probabiliste.
b. explantation de la totalité du matériel de SCP.
c. explantation du neurostimulateur seul.
d. explantation du neurostimulateur et des extensions.
Mémento didactique
1)- Introduction
L’infection de matériel est la complication la plus fréquente d’une chirurgie de stimulation cérébrale profonde (SCP). Son incidence rapportée dans la littérature est variable (de 1 à plus de 20%1). Elle se situe entre 1 et 10% dans les études les plus récentes2–7. Le risque infectieux décrit une courbe de Gauss avec un pic de survenue maximal à 1 mois et demi postopératoire puis décroit quasiment totalement après les 3 premiers mois postopératoires (période dite « périopératoire »)1 et est de l’ordre de 3-4% sur cette période7,8. Le risque infectieux persiste ensuite faiblement avec un deuxième pic aux environs du 8e mois post-opératoire7,8. L’infection de matériel peut rarement survenir à distance (> 1 an, dite aussi « infection retardée »), sans facteur retrouvé ou suite à une érosion cutanée8,9.
Il n’y a pas de facteur de risque clairement identifié. La maladie de Gilles de la Tourette représente éventuellement un facteur de risque de survenue d’une infection périopératoire. Selon certaines études, le risque infectieux serait plus important en cas de changement de neurostimulateur qu’en cas de primo-implantation (10% vs 3%), ce risque augmentant à chaque changement (de 5% au premier jusqu’à plus de 20% aux troisième et quatrième), ainsi que pendant la période estivale.
Le point de départ de l’infection se situe dans la grande majorité des cas au niveau du neurostimulateur. Elle reste le plus souvent locorégionale (tissus sous-cutanés autour du matériel), le risque d’abcès cérébral étant très faible.
Les germes les plus fréquemment en cause sont des bactéries Gram positives de la flore cutanée : Staphylococcus aureus méthi-S (37,5% des cas), Propionibacterium acnes (43,5%), Staphylococcus epidermidis… seuls ou dans le cas d’infections polymicrobiennes. Les infections survenant dans les 3 premiers mois post-opératoires sont le plus souvent à germe unique ; les infections retardées (> 3 mois) sont le plus souvent polymicrobiennes (> 70% des cas).
Il n’y a pas de données dans la littérature concernant le pronostic après une infection d’un implant de SCP mais l’arrêt brutal de ce traitement entraîne une décompensation aiguë de la maladie neurologique sous-jacente, avec des cas de décès rapportés dans la littérature (pneumopathie d’inhalation sur décompensation du syndrome akinéto-rigide et des signes axiaux avec dysphagie), et nécessite une prise en charge conjointe avec l’équipe de Neurologie.
Video : Conduite à tenir devant une infection des implants de stimulation cérébrale profonde.
Jean-Jacques Lemaire.
2)- Description du matériel de Stimulation Cérébrale Profonde
- Le matériel est composé des éléments suivants (Figure 1) :
- une ou des électrode(s) de stimulation implantée(s) dans une structure profonde du cerveau et fixée au crâne par une système vissé ou impacté dans l’os ;
- une ou des extension(s) sous-cutanée(s) – plus solide(s) –raccordée(s) aux électrodes en position rétro-auriculaire est (sont) tunnellisée(s) jusqu’à la région pectorale (ou abdominale) ;
- le neurostimulateur (ou « pile ») qui délivre le courant, situé en position pectorale ou abdominale et auquel sont branchés les extensions. Parfois, pour des raisons de compatibilité, un adaptateur est interposé entre les extensions et le neurostimulateur et prend place lui aussi dans la cavité pectorale ou abdominale).
La plupart des patients implantés le sont bilatéralement selon le schéma suivant : deux électrodes de stimulation connectées du même côté à deux extensions puis à un neurostimulateur. Des montages différents peuvent exister et en cas de doute, une simple radiographie permet de visualiser l’ensemble du matériel (Figure 2).
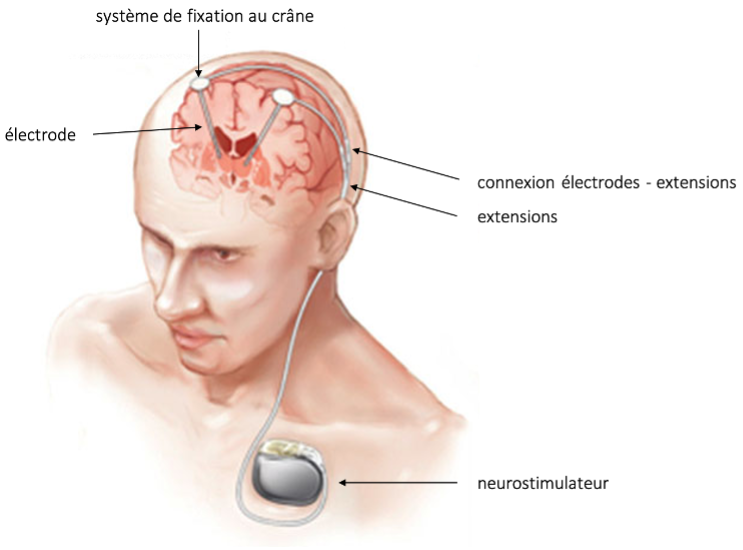
Figure 1 : dispositif de SCP
(Modified from Edwards CA, Kouzani A, Lee KH, Ross EK. Neurostimulation Devices for the Treatment of Neurologic Disorders. Mayo Clin Proc 2017 ;92:1427-1444)
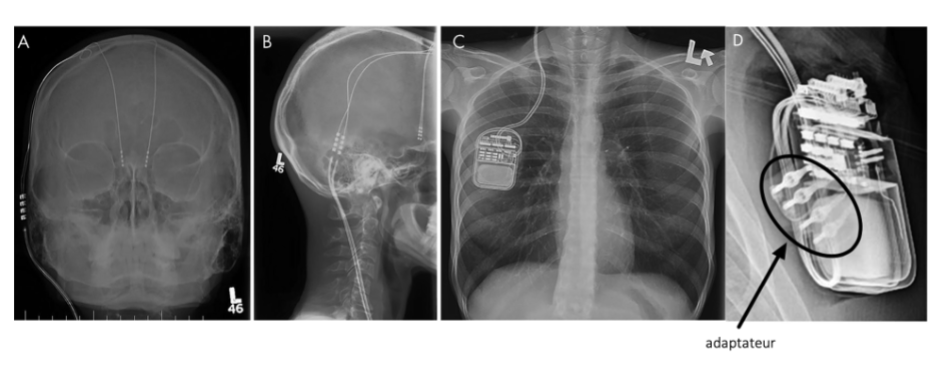
D : exemple d’un adaptateur entre l’extension et le neurostimulateur (Medtronic, MRI guidelines for Medtronic deep brain stimulation systems 2015-12-01)
Figure 2 : radiographies d’un dispositif de SCP
A, B, C : montage classique (Boutet A, Rashid T, Hancu I, Elias GJB, Gramer RM, Germann J, et al. Functional MRI Safety and Artifacts during Deep Brain Stimulation : Experience in 102 Patients. Radiology. 2019 Oct ;293(1):174–83)
D : exemple d’un adaptateur entre l’extension et le neurostimulateur (Medtronic, MRI guidelines for Medtronic deep brain stimulation systems 2015-12-01)
3)- Diagnostic d’une infection d’implant de SCP
- Diagnostic positif :
Le point de départ le plus fréquent est le neurostimulateur (pose ou remplacement).
Le diagnostic est avant tout clinique et repose sur l’inspection des cicatrices (toutes !) et du trajet du matériel car l’infection va se propager le long du matériel. Le premier signe clinique (souvent le seul) est un défaut de cicatrisation (dans le cas d’une chirurgie récente), une cicatrice inflammatoire, un gonflement au niveau d’une cicatrice ou le long du trajet des extensions (abcès sous-cutané) et/ou une érosion avec mise à nu du matériel.
Les signes généraux (fièvre…) et biologiques (syndrome inflammatoire) sont le plus souvent absents. - Rechercher les complications :
Les complications d’ordre neurologique (méningite, abcès cérébral) sont rarissimes. - Examens complémentaires :
Aucun examen complémentaire n’est requis pour poser le diagnostic.
La ponction lombaire, la TDM et/ou l’IRM cérébrale (sous condition pour cette dernière, en raison du matériel de SCP) peuvent être nécessaires en cas de doute (ex : tableau de méningite ; recherche d’abcès en cas de confusion ou de déficit neurologique associé, etc…).
4)- Prise en charge
La prise en charge d’une infection d’implant de SCP est double : chirurgicale et médicale.
- Traitement chirurgical :
L’infection du matériel nécessite son retrait. Le retrait du matériel est une urgence relative qui doit être faite le plus vite possible.
- Si l’infection est localisée au niveau du neurostimulateur, un retrait partiel du matériel (neurostimulateur et tout ou partie des extensions) est nécessaire le plus rapidement possible afin d’espérer garder les électrodes intracérébrales saines. Il n’est pas nécessaire d’arrêter le neurostimulateur avant de le retirer.
- incision sur le trajet des extensions en dessous de l’incision pariétale où se situe le raccord électrodes-extensions (et ce afin de ne pas sectionner les électrodes intracérébrales) et section des extensions
- reprise de l’incision pectorale (ou abdominale) et retrait du matériel (neurostimulateur et extensions) par cette cicatrice d’aval
- lavage, parage des tissus
- fermeture sous-cutanée et cutanée.
- Si l’infection est localisée au niveau de la cicatrice rétro-auriculaire (raccord électrodes-extensions), le retrait partiel du matériel (extensions et neurostimulateur) est souvent un échec et cela nécessite le plus souvent le retrait complet9 ; la prise en charge est à évaluer au cas par cas. On procède malgré tout dans l’immense majorité des cas au retrait partiel du matériel (meilleure acceptation par le patient et par l’équipe de soins). Dans le cas d’un retrait partiel, il faut retirer la totalité des extensions en reprenant prudemment la cicatrice rétro auriculaire et en déconnectant les extensions des électrodes à l’aide d’un tournevis adapté.
- Si l’infection est localisée au niveau d’une cicatrice coronale ou si présence d’une infection intra-cérébrale confirmée (abcès…), il faut retirer la totalité du matériel (électrodes intracérébrales inclues).
L’envoi du matériel en bactériologie est recommandé (identification du ou des germe(s), antibiothérapie adaptée à l’antibiogramme) ainsi que la mise en culture du tissu sous cutané.
- Traitement médical :
- antibiothérapie : il n’y a pas de recommandations sur le traitement antibiotique à instaurer pour ce type d’infection ni sur sa durée. Les Infectiologues se basent sur les recommandations en vigueur pour les infections de dispositif implantable cardiaque (pacemaker etc…) qui proposent en première intention l’association β-lactamine (par exemple : Cefotaxime ou Ceftriaxone ; Vancomycine si suspicion de SARM ; Clindamycine si allergie à la Pénicilline) + Rifampicine pour une durée de 2 à 6 semaines15. Certaines études menées par des équipes de Neurochirurgiens tendent vers de telles recommandations, et notamment sur l’ajout de la Rifampicine pour son action sur le biofilm bactérien3,9. Cependant, en pratique et en l’absence de complications neurologiques, certaines équipes proposent une antibiothérapie courte (1 semaine) par β-lactamine seule.
- adaptation du traitement médicamenteux neurologique en amont de la chirurgie de retrait (contacter l’équipe de Neurologie). L’arrêt brutal de la SCP va entraîner une décompensation aiguë de la maladie sous-jacente avec des risques potentiellement graves.
- Sont contre-indiqués :
- la ponction percutanée d’une collection sous-cutanée au niveau du matériel,
- une antibiothérapie probabiliste sans retrait du matériel,
- l’utilisation de la monopolaire, même si le neurostimulateur est éteint (risque d’arc électrique et de lésion cérébrale), sauf avec le système PEAK PlasmaBladeTM (Medtronic).
5)- Délai pour la réimplantation
Le délai avant réimplantation est classiquement de 3 mois minimum9.
On peut proposer un délai plus court (10 jours) si l’arrêt de la stimulation entraîne des risques majeurs pour le patient (discussion au cas par cas).
Réponses
1) Réponses : a. b. d.
2) Réponse : c.
3) Réponse : d.
Ressources
Cours « Conduite à tenir devant une infection des implants de stimulation cérébrale profonde » (JNE 2019)
Cours « Stimulation cérébrale profonde dans le traitement de la maladie de Parkinson » (Encyclopédie Neurochirurgicale – techniques chirurgicales, 2015) : http://www.neurochirurgica.org/spip.php?article20
Références annotées
Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson’s disease.
Benabid AL et al. The Lancet Neurology, 2009
Première revue de la littérature sur la SCP dans la Maladie de Parkinson par le fondateur de la technique, Alim Louis Benabid. Revue exhaustive à l’époque sur la technique chirurgicale, les résultats cliniques et les complications.
Deep Brain Stimulation Hardware-Related Infections : A Report of 12 Cases and Review of the Literature.
Fily F et al. Clinical Infectious Diseases, 2011
Première série rétrospective monocentrique et revue de la littérature consacrée aux infections sur matériel de SCP. Discussion sur le traitement antibiotique, sa durée mais aussi sur la stratégie à adopter en fonction du site où se situe l’infection et sur le délai avant réimplantation.
Surgical Site Infections after Deep Brain Stimulation Surgery : Frequency, Characteristics and Management in a 10-Year Period.
Bjerknes S et al. PLoS ONE, 2014
Série rétrospective monocentrique sur 10 ans (588 interventions chez 368 patients). Taux d’infection de 5.6% assez représentatif de ce que l’on observe dans les séries plus récentes. Discussion intéressante sur la possibilité de traitement conservateur mais à réserver à des cas particuliers, dans des centres experts, et sur les modalités du traitement antibiotique, sa durée et sur l’intérêt de rajouter la Rifampicine.
Deep Brain Stimulation Generator Replacement in End-Stage Parkinson Disease.
Carlson JD et al. World Neurosurgery. 2019
Série rétrospective monocentrique sur 20 ans mais s’intéressant uniquement aux patients parkinsoniens (216 patients). Répartition bi-modale des infections avec des pics à 3 et à 8 mois postopératoires.
Références
1. Benabid AL, Chabardes S, Mitrofanis J, Pollak P. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson’s disease. The Lancet Neurology. 2009 Jan ;8(1):67–81.
2. Baizabal Carvallo JF, Mostile G, Almaguer M, Davidson A, Simpson R, Jankovic J. Deep Brain Stimulation Hardware Complications in Patients with Movement Disorders : Risk Factors and Clinical Correlations. Stereotact Funct Neurosurg. 2012 ;90(5):300–6.
3. Bjerknes S, Skogseid IM, Sæhle T, Dietrichs E, Toft M. Surgical Site Infections after Deep Brain Stimulation Surgery : Frequency, Characteristics and Management in a 10-Year Period. Gross RE, editor. PLoS ONE. 2014 Aug 14 ;9(8):e105288.
4. Tolleson C, Stroh J, Ehrenfeld J, Neimat J, Konrad P, Phibbs F. The Factors Involved in Deep Brain Stimulation Infection : A Large Case Series. Stereotact Funct Neurosurg. 2014 ;92(4):227–33.
5. Jitkritsadakul O, Bhidayasiri R, Kalia SK, Hodaie M, Lozano AM, Fasano A. Systematic review of hardware-related complications of Deep Brain Stimulation : Do new indications pose an increased risk ? Brain Stimulation. 2017 Sep ;10(5):967–76.
6. Hardaway FA, Raslan AM, Burchiel KJ. Deep Brain Stimulation-Related Infections : Analysis of Rates, Timing, and Seasonality. Neurosurgery. 2018 Sep 1 ;83(3):540–7.
7. Abode-Iyamah KO, Chiang H-Y, Woodroffe RW, Park B, Jareczek FJ, Nagahama Y, et al. Deep brain stimulation hardware–related infections : 10-year experience at a single institution. Journal of Neurosurgery. 2019 Feb ;130(2):629–38.
8. Carlson JD, Palmer M, Hoefer A, Cox E, McLeod P, Mark J, et al. Deep Brain Stimulation Generator Replacement in End-Stage Parkinson Disease. World Neurosurgery. 2019 Aug ;128:e683–7.
9. Fily F, Haegelen C, Tattevin P, Buffet-Bataillon S, Revest M, Cady A, et al. Deep Brain Stimulation Hardware-Related Infections : A Report of 12 Cases and Review of the Literature. Clinical Infectious Diseases. 2011 Apr 15 ;52(8):1020–3.
10. Servello D, Sassi M, Gaeta M, Ricci C, Porta M. Tourette syndrome (TS) bears a higher rate of inflammatory complications at the implanted hardware in deep brain stimulation (DBS). Acta Neurochir. 2011 Mar ;153(3):629–32.
11. Pepper J, Zrinzo L, Mirza B, Foltynie T, Limousin P, Hariz M. The Risk of Hardware Infection in Deep Brain Stimulation Surgery Is Greater at Impulse Generator Replacement than at the Primary Procedure. Stereotact Funct Neurosurg. 2013 ;91(1):56–65.
12. Thrane JF, Sunde NA, Bergholt B, Rosendal F. Increasing Infection Rate in Multiple Implanted Pulse Generator Changes in Movement Disorder Patients Treated with Deep Brain Stimulation. Stereotact Funct Neurosurg. 2014 ;92(6):360–4.
13. Reuter S, Deuschl G, Falk D, Mehdorn M, Witt K. Uncoupling of dopaminergic and subthalamic stimulation : Life-threatening DBS withdrawal syndrome : Life-Threatening DBS Withdrawal Syndrome. Mov Disord. 2015 Sep ;30(10):1407–13.
14. Hariz MI, Johansson F. Hardware failure in parkinsonian patients with chronic subthalamic nucleus stimulation is a medical emergency. Mov Disord. 2001 Jan ;16(1):166–8.
15. Sandoe JAT, Barlow G, Chambers JB, Gammage M, Guleri A, Howard P, et al. Guidelines for the diagnosis, prevention and management of implantable cardiac electronic device infection. Report of a joint Working Party project on behalf of the British Society for Antimicrobial Chemotherapy (BSAC, host organization), British Heart Rhythm Society (BHRS), British Cardiovascular Society (BCS), British Heart Valve Society (BHVS) and British Society for Echocardiography (BSE). Journal of Antimicrobial Chemotherapy. 2015 Feb 1 ;70(2):325–59.