2.3 Infections post-opératoire de la chirurgie du rachis.
Julien TODESCHI, M.D., CHRU Strasbourg, Décembre 2021
Questions
1. Parmi ces caractéristiques lesquels sont des facteurs de risque d’infections post-opératoires du rachis ?
a. La mise en place de matériel
b. L’âge de patient < 65 ans
c. Une obésité
d. La présence d’un diabète
e. Les approches chirurgicales antérieures
2. Concernant les infections post opératoire du rachis, quelles sont les propositions exactes ?
a. La formation d’un biofilm est un facteur indispensable à la chronicisation de l’infection
b. Deux prélèvements bactériologiques « profonds » au bloc opératoire sont suffisant
c. L’hyperleucocytose est classiquement retrouvée dans les infections post opératoire du rachis
d. La TDM TEP 18FDG est une bonne alternative en cas de contre-indication à l’IRM
e. L’instillation de Vancomycine en per opératoire doit être systématique en cas d’instrumentation étendue
3. Concernant le traitement des infections post-opératoires du rachis, quelles sont les propositions exactes ?
a. L’association Beta-lactamine + Glycopeptide est le schéma classique du traitement antibiotique
b. La durée habituelle de l’antibiothérapie est de 6 semaines
c. Dans les infections « tardives » l’antibiothérapie IV doit être poursuivie pendant 1 mois minimum
d. Dans les infections « précoces » une antibiothérapie unique est suffisante
e. L’ablation du matériel doit être effectué quelques soit le moment de l’infection
MEMENTO DIDACTIQUE
Introduction
Les infections post-opératoires compliquent 1 à 10% des chirurgies du rachis [1, 2] et déterminent fréquemment des séquelles douloureuses chroniques invalidantes. Il s’agit de la première cause de ré-intervention dans le premier mois post opératoire [3].
Le diagnostic souvent manifeste en phase aiguë l’est beaucoup moins en phase chronique et repose sur un faisceau d’arguments clinico-radiologique [4]. Aussi, le recours à des examens complémentaires est indispensable afin d’établir le diagnostic mais également de guider la prise en charge thérapeutique [5, 6].
L’enjeu est également fonctionnel car ces infections sont à l’origine d’un risque neurologique et mécanique dépendant de la zone rachidienne, de la voie d’abord, de la technique opératoire et du matériel mise en place [7].
Dans cette complication, la précision du diagnostic est nécessaire car elle permet de limiter l’émergence de bactéries résistantes. Elles entraînent un coût médico-économique non négligeable et sont la source de potentielles conséquences médico-légales.
Pathogénie
Mécanismes physiopathologiques
La physiopathologie des infections post opératoire du rachis est dépendant du germe bactérien en cause. L’exemple de l’infection au staphylococcus aureus est un bon modèle pour la compréhension de cette pathologie.
À la phase aiguë de l’infection, il existe une sécrétion importante de toxines engendrant une invasion et une dissémination de l’infection (caractère bruyant initialement avec réponse inflammatoire marquée et échappement à la phagocytose). Cette dissémination entraine une cytotoxité et une destruction osseuse. Progressivement, la sécrétion d’adhésines permet la formation d’un biofilm et l’internalisation bactérienne dans les cellules (échappement possible au système immunitaire et résistance aux antibiotiques). Cela engendre une diminution de la réponse inflammatoire clinico-biologique. En somme, le passage de l’infection aiguë à chronique est secondaire à une adaptation bactérienne.
La phase chronique est dépendante de 3 facteurs :
- le biofilm : communauté bactérienne adhérée aux matériel ou au séquestre osseux. Développement de mécanisme de tolérance aux antibiotiques (barrière physique, réduction du métabolisme bactérien, induction de gène de résistance spécifiques + augmentation de la fréquence des mutations,..)
- La vie intra cellulaire : interactions avec les cellules osseuses (ostéoblastes), internalisation des bactéries dans les cellules entrainant un réservoir de bactérie.
- Le « small colony variant » (SCV) : modifications phénotypiques des bactéries (entrainant une résistance accrue aux antibiotiques, une croissance lente, une bonne adhérence et une survie intra cellulaire)
Facteurs de risque [8-10]
| Patient | Péri-opératoire |
| Age > 65 ans Diabète (RR x 2) Obésité Tabac Alcool |
Durée chirurgie (>5h)
Durée d’hospitalisation post opératoire longue Pertes sanguines
Incontinence post op
Procédure de résection tumorale
Voie d’abord postérieure (RR x 2, risque faible dans les abords antérieur) Mise en place de matériel (RR x 8)
Fixation pelvienne (proximité avec périnée, zone d’appui en position assise,..)
Étendue du montage (surtout si >7 niveaux)
Geste d’ostéotomie|
Caractérisation de l’infection
Les principaux éléments à prendre en compte dans une infection rachidienne post-opératoire sont :
- La localisation au niveau du rachis
- Le caractère superficiel ou profond (par rapport à l’aponévrose)
- La survenue sur rachis « instrumenté » ou non instrumenté
- Le(s) germe(s) incriminé(s).
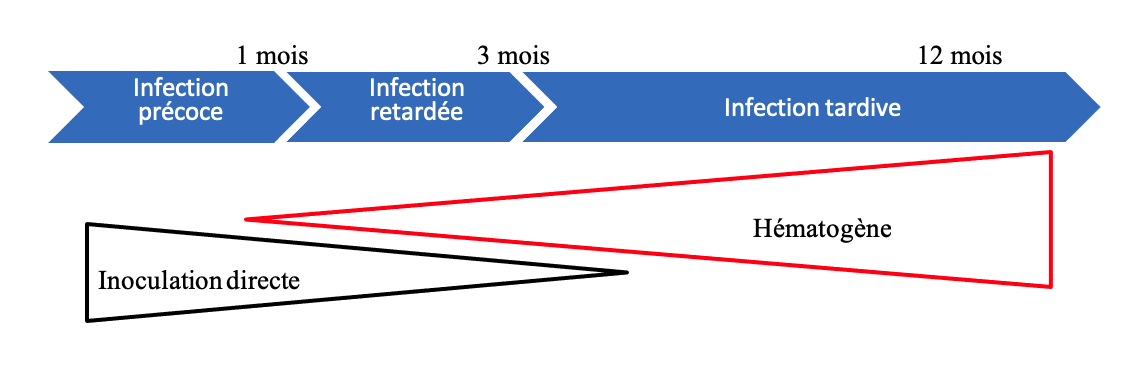
Par ailleurs, on distingue schématiquement les infections rachidiennes post-opératoires précoces, retardées et tardives. Le délai de survenue de l’infection est essentiel car il conditionne la prise en charge thérapeutique.
| Pyogènes à croissance rapide : | Pyogènes à croissance lente : |
| Staphylococcus aureus +++ / bacilles Gram | staphylocoques à coagulase négative, |
| négatif ,… | Propionibacterium acnes, S. aureus, BGN |
| ,… |
Diagnostic de l’infection post-opératoire
Le diagnostic repose sur un faisceau d’argument dont l’examen clinique est l’axe central, conforté par l’imagerie et étayé par l’étude bactériologique.
Examen clinique [4, 11-13]
La présentation clinique est constituée d’un cortège de symptômes extrêmes divers d’un patient à l’autre. Ils sont regroupés en :
- Un syndrome rachidien marqué par une résurgence de la douleur rachidienne, progressive, de nature inflammatoire mais également mécanique avec contracture des muscles paravertébraux. Cette douleur, pouvant devenir plus importante qu’avant l’intervention, représente le signe clinique le plus fréquemment détecté et se développe généralement entre 1 à 6semaines post opératoire [14]. La marche peut devenir difficile, précautionneuse avec des amplitude de mouvement restreinte.
- Un syndrome inflammatoire local centré sur la cicatrice (masse fluctuante, bombement péri cicatricielle, rougeur cutanée, fistulisation de pus à la peau , écoulement d’allure purulent) est souvent retrouvé même si il peut être absent et incomplet.
- Un syndrome inflammatoire systémique : caractérisé par une fièvre (rarement mis en évidence), une asthénie, des sueurs nocturnes.
Examens Biologiques [12, 15]
Souvent peu spécifique dans les infections aiguë, ils peuvent être utile dans les infections chroniques avec la mise en évidence d’un syndrome inflammatoire. L’hyperleucocytose est rare (5%) avec une CRP élevée (Pic à J2 [15]) retrouvée chez 83% des patients. Par ailleurs, l’évolutivité de la CRP rend intéressant l’étude de sa cinétique.
À noter que la VS élevée chez 55% des patients ainsi que la pro-calcitonine sont moins utilisées en pratique courante.
Examens bactériologiques
La recherche bactériologique s’avère indispensable mais malheureusement n’aboutit que peu souvent en raison des fréquentes contaminations, du caractère poly microbien de la sur infection et de la stérilisation des foyers liées au multiples usages actuels des antibiotiques. Néanmoins, ces prélèvements lorsqu’ils sont contributifs permettent d’adapter le traitement antibiotique (antibiogramme).
- Prélèvements systémiques : En cas d’infection aiguë, des hémocultures doivent être réalisées lors des pics fébriles afin de rechercher une bactériémie.
- Prélèvements « superficiels » : de la fistule ou de la cicatrice. Ils sont d’interprétation difficile en raison du risque de contamination et de mauvaise concordance avec les prélèvements profonds [16].
- Prélèvements « profonds » : à faire avant l’antibiothérapie ou après un arrêt prolongé des antibiotiques
- Chirurgical au bloc opératoire
- Le nombre de prélèvements optimum est de 5 (pouvant aller jusqu’à 7 maximum mais il convient d’éviter les prélèvements trop nombreux qui pourraient augmenter le risque de contamination bactérienne) [4]. L’examen direct est souvent négatif (82% des patients) [11] et la mise en culture doit être prolongée (10 jours).
- Les prélèvements se réalisent sur des sites anatomiques différents, macroscopiquement pathologiques : pus et tissus (ni trop, ni trop peu, afin d’augmenter la sensibilité tout en limitant les contaminations)
- Un prélèvement pour examen anatomopathologique : afin de quantifier les polynucléaires neutrophiles (PNN) et rechercher une autre étiologie qu’une atteinte bactérienne peut être réalisé.
- Les approches moléculaires , la PCR universelle 16S ou PCR ciblées sont à réserver quand les cultures sont négatives et qu’il existe une forte suspicion d’infection notamment si le patient est sous traitement antibiotique.
- Chirurgical au bloc opératoire
-
- Radiologique : la ponction-biopsie disco-vertébrale percutanée sous contrôle fluoroscopique ou scanner en cas de suspicion de spondylodiscite ou de spondylite reste l’examen de référence. Indispensable si les hémocultures ne permettent pas l’identification formelle du micro-organisme responsable ce qui représente la majorité des cas après chirurgie discale. Il convient de la répéter en cas de forte suspicion radio-clinique si le premier prélèvement est revenu négatif. Effectivement, le risque de faux négatif est majoré si la biopsie a été réalisée à la phase précoce de la maladie. Dans tous les cas il est recommandé de réaliser 6 prélèvements (3 prélèvements osseux et 3 de disque)[17].
Examens Radiologiques
En phase « aiguë », l’interprétation est difficile, limitée par l’inflammation locale post- opératoire, par les artéfacts liés au matériel éventuel, etc. Elle présente donc le risque d’être faussement rassurante. En phase « chronique », l’imagerie est indispensable permettant de d’appuyer le diagnostic et guider la prise en charge thérapeutique.
- L’ IRM : est l’examen de référence à demander en première intention.
- Elle dispose d’une bonne sensibilité (96%) et permet un diagnostic précoce
- Représente le meilleur examen pour l’identification d’abcès des parties molles, épidural, les épidurites, les atteintes neurologique.
- En cas de spondylodiscite, elle peut montrer des images en miroir (atteinte du disque et des corps vertébraux) en Hypo-signal T1 réhaussé après injection de gadolinium et Hyper-signal T2.
- En cas de mise en place de matériel
- Demander des séquences adaptées pour limiter les artéfacts [18]
- Rechercher des collections au pourtour des têtes de vis [19]
- La TDM TEP 18FDG [6, 20]
- Surtout intéressante dans les infections chroniques et particulièrement si contre-indications à l’IRM, artéfacts métalliques importants, cages inter somatiques, ou lors de cimentoplastie (PMMA)
- Meilleur examen que la scintigraphie au TC99m ou au Gallium 67 en raison d’une sensibilité excellente
- Permet d’évaluer les limites de l’abcès, ses communications avec les parties molles et évite les artéfacts de l’IRM/TDM liés aux implants
- La TDM avec injection de produit de contraste
- Indiquée à la phase aiguë uniquement si IRM indisponible
- Les signes évocateurs de spondylodiscite : diminution de la densité discale, pincement discal, érosion et géodes des plateaux, effacement de la corticale des plateaux, épaississement circonférentiel autour du disque, infiltration de la graisse para-vertébrale.
- Reste indispensable dans l’optique d’une dépose de matériel (Recherche une mobilisation et/ou une rupture d’implant)
- À distance, intéressante pour la recherche de pseudarthrose et afin d’évaluer la statique vertébrale.
- Autres examens (sensibilité et spécificité moins bonnes)
- Radiographies standard
- Permet d’identifier des anomalies d’apparition tardive (effacement du liseré corticale, pincement discal, érosion osseuse, géodes sous- chondrales,…)
- Scintigraphie (au Gallium / aux leucocytes marqués)
- Bonne alternative en cas de contre-indication ou de non disponibilité de l’IRM. Elle montre un foyer d’hyperfixation non spécifique.
- Radiographies standard
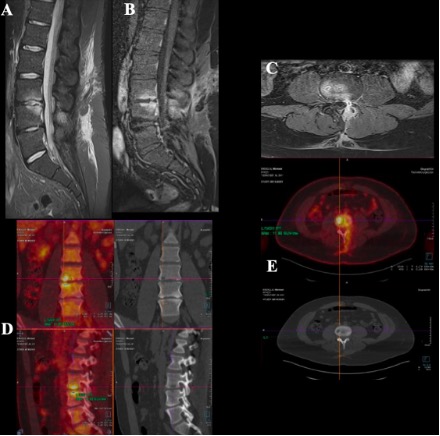
Exemple 1 : Patient de 24ans présentant de violentes lombalgies d’horaire mixte associées à une cruralgie L4 gauche. L’ IRM lombaire met en évidence un œdème vertébral en miroir L3-L4 associé à un aspect de lyse osseuse des plateaux. Images : A) Hypersignal STIR ; B et C) Hypersignal T1 après injection de gadolinium. La TEP TDM au 18FDG (images D et E) objective un hypermétabolisme intense au niveau de l’émergence de la racine nerveuse L4 gauche ainsi que des érosions osseuses en miroir des plateaux vertébraux inférieur de L3 et supérieur de L4 en faveur d’une origine infectieuse.
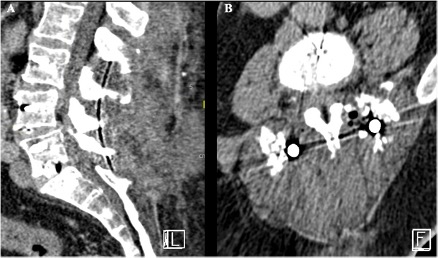
Exemple 2 : Patiente de 66ans. À J5 post op d’un TLIF L3-S1 : cicatrice inflammatoire, douloureuse et boursouflée. TDM lombaire avec injection (images A et B) retrouvant une collection volumineuse de la loge opératoire au niveau des parties molles en faveur d’une infection post-opératoire précoce du rachis.
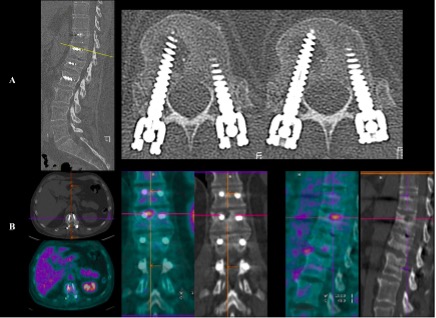
Exemple 3 : Patient de 64ans présentant à 13mois d’une ostéosynthèse per cutanée T11-L2 effectuée pour fracture post traumatique type B des dorsalgies légères inhabituelles. La TDM dorso-lombaire (image A et B) retrouve une image d’ostéolyse autour de la vis T12 droite. La TEP TDM au 18FDG (image C et D) objective un hypermétabolisme autour de la partie distale de la vis T12 droite confirmant la suspicion d’infection post- opératoire tardive du rachis.
Traitement de l’infection post opératoire du rachis
La prévention
Plusieurs mesures peuvent être entreprises pour limiter le risque de survenu d’une infection post opératoire du rachis :
- Optimisation pré opératoire : Une décontamination cutanée pré opératoire indispensable notamment pour son action contre le staphylococcus aureus. L’arrêt du tabac [21, 22] permet une diminution du risque infectieux de 30%, améliore les résultats fonctionnels et diminue le risque de pseudarthrose.
- Optimisation per opératoire
- L’environnement au bloc opératoire [23] : Plusieurs éléments sont important comme le traitement de l’air (flux directionnel, Norme ISO7, recyclages particules), Limiter le nombre d’intervenants et d’aller/venus ainsi qu’ouvrir de façon séquentielle le matériel opératoire.
- L’instillation de Vancomycine (topique) : L’efficacité de l’instillation de vancomycine est envisagée mais discutée avec un niveau de preuve faible dans la littérature malgré un nombre de publications important. Par ailleurs les conséquences écologiques restent mal étudiées.
- L’antibioprophylaxie [24] : utilisation d’une molécule la moins large possible, introduit minimum 30 min avant l’incision. Systématiquement si mise en place d’un implant. Un protocole écrit et validé par l’ensemble des acteurs locaux du soins est préconisé.
- Optimisation post opératoire
- La gestion des soins post opératoire et particulièrement des pansements reste controversé [25]. Il n’existe pas de règles, pas de preuve ni de supériorité des pansements. Si un pansement est mise en place il convient d’éviter les changements répétés (risque augmentation des infections) [26].
- À noter que la réhabilitation précoce (RAAC) entraîne une diminution de l’incidence des ISO [27].
Le traitement médicamenteux : Les antibiotiques
Les infections post-opératoires du rachis relèvent de manière générale d’une double antibiothérapie adaptée aux prélèvements profonds (initialement intraveineuse puis relayée par voie orale). Leurs mise en place se veut volontiers multidisciplinaire avec un traçage dans le dossier du patient. L’association à un lavage-parage du foyer opératoire peut dans certains cas (volume abcès, présence de matériel d’ostéosynthèse,…) être indispensable car une antibiothérapie isolée n’est pas efficace [13].
Les antibiotiques choisis devront avoir le spectre le plus étroit possible avec une bonne diffusion osseuse et intra-cellulaire.
Le but étant d’avoir une action rapide, forte (posologie élevée), bactéricide plus que bactériostatique.
Choix des molécules
Il n’existe actuellement aucune recommandation avec une grande hétérogénéité des pratiques. Les protocoles sont dépendants des établissements de santé et s’adaptent à l’écologie bactérienne locale. Certaines règles sont néanmoins admises :
- Une Beta-lactamine (Cefepime, Pipéracilline-Tazobactam, Aztreonam,…) pour être actif contre les staphylocoques (Méti S,…), Streptococcus, Entérobactéries, Pseudomonas Aeruginosa…
- Associé à des Glycopeptides ou autres (Vancomycine, Teicoplanine, daptomycine, Linézolide,…) pour être actif contre le Staphlococcus sp Méti R, Enterocoques, C. Acnes,…
La bithérapie initiale permet d’élargir le spectre mais une attention particulière doit être portée sur les effets secondaires (digestif, perturbation de la flore, risque de résistance) et notamment la toxicité rénale potentielle [28].
La durée des antibiotiques [29, 30]
La durée habituellement admise est de 6 semaines (à 3 mois) avec une adaptation selon le terrain et le caractère chronique de l’infection. La tendance étant à diminuer au maximum la période en intra veineux (IV) en raison des effets secondaires et des conséquences liées au cathéter (veinites,…) avec une efficacité similaire par la voie per os [31].
Une durée de 7 jours IV initiale semble être le Gold standard actuellement.
Le traitement chirurgical : décompression / lavage-parage-drainage / stabilisation
Les modalités du traitement chirurgical dépend du moment de survenu et de la localisation de l’infection rachidienne.
- Les infections précoces (< 1 mois post-opératoire) appellent à une reprise au bloc opératoire sous anesthésie générale. La prise en charge consiste en un débridement, un lavage abondant avec parage, au cours de laquelle des prélèvements bactériologiques multiples doivent être réalisés (� 5). Il n’existe pas dans la littérature de preuve quant à l’utilisation in situ de Bétadine, Eau oxygénée, Dakin,…Si présence de matériel : ce dernier est nettoyé et laissé en place. L’ablation de la greffe osseuse reste débattue. La fermeture pouvant se faire sur drainage(s) aspiratifs selon les habitudes locales (DAIR protocol des anglo-saxons).
- Les infections tardives (> 3 mois) se distinguent en :
- Infections sur rachis stable et consolidé, relevant alors d’une ablation du matériel d’ostéosynthèse [12].
- Infections sur rachis instable et non consolidé. Un traitement séquentiel est alors la règle : ablation du matériel d’ostéosynthèse initialement puis pour traiter l’infection il faudra traiter la pseudarthrose (l’inflammation engendrée par la pseudarthrose peut entretenir l’infection). Il convient de renforcer la greffe et corriger les troubles de l’équilibre souvent associés.
- Les infections retardées (1-3 mois post-opératoires) relèvent d’une attitude intermédiaire à discuter au cas par cas.
- Options à évaluer (sans véritable niveaux de preuve)
- Instillation préventive d’antibiotique local (par exemple poudre de vancomycine)
- Irrigation-lavage / second look en cas d’infection sévère (tissus nécrotiques purulents, persistance d’écoulements, patient restant fébrile, infections à Staphylocoques ou BMR)
- Fermeture avec VACthérapie / Lambeau
La spondylodiscite post opératoire ne nécessite pas de geste chirurgical en 1ère intention mais uniquement un traitement antibiotique adapté aux germes retrouvés à la ponction-biopsie. Il est d’ailleurs fortement recommandé de ne pas recourir à un traitement chirurgical lorsqu’il n’existe qu’un syndrome rachidien fébrile ou que des douleurs radiculaires au niveau lombaire [17]. La chirurgie de décompression et/ou drainage est par contre indispensable en urgence devant l’apparition récente (< 72h) de signes neurologiques déficitaires (sensitivo-moteurs et/ou sphinctériens)[17]. À distance, une intervention chirurgicale de stabilisation peut être nécessaire en cas de déformation majeure (supérieure à 10° cyphotique à l’étage cervical, supérieure à 20° à l’étage thoraco-lombaire et en cas de destruction de plus de 50% du corps vertébral ou de pseudarthrose séquellaire)[17]. Par ailleurs, le traitement orthopédique par minerve ou corset garde toute sa place dans la gestion de ces patients même en contexte post opératoire. Effectivement, la mise en place d’une orthèse diminue les douleurs rachidiennes et prévient les déformations secondaires.
Les abcès épiduraux ainsi que musculaires doivent être mis à plat dans la mesure du possible et s’ils entrainent une compression neurologique responsable de signes cliniques. Le risque hémorragique n’est pas nul dans les abcès épiduraux et le lavage chirurgical ne doit pas entrainer un sur-risque fonctionnel au patient.
À noter que les cas de désunion cicatricielle simple peuvent être traités par soins locaux seuls.
Évolution, devenir et suivi des infections post opératoire du rachis [14, 32-34]
Hickmann et al. ont, dans l’une des plus importante série de la littérature, constatés que les patients atteints d’infection post opératoire du rachis après instrumentation postérieure (thoraco-lombo-sacré) pouvaient être traités avec succès dans la majorité des cas. Plusieurs chirurgies de révisions étaient parfois nécessaire avec un taux de satisfaction final des patients de 72,7%. À noter dans cette même série de 176 cas un pourcentage de décès de 1,4% .
Concernant les spondylodiscites post opératoires, après un traitement conservateur, le pronostic à long terme est considéré comme bon avec des taux de réussite rapportés de 70 % à 83 %. Néanmoins, la littérature reste assez controversée avec pour certains une majorité de patient présentant des douleurs rachidiennes et pour d’autres une majorité de patient exempt de douleur avec une évolution locale vers une ankylose osseuse ou une union dite fibreuse dans les 2ans suivant leur infection. Certains auteurs recommandent même une prise en charge chirurgicale précoce afin de raccourcir les séjours hospitaliers, la durée de l’antibiothérapie et prévenir la cyphose secondaire [14].
Dans tous les cas il est indispensable de suivre ces patients à moyen terme, sur une durée minimale de 2 ans. La prise en charge se faisant de façon pluridisciplinaire, alliant :
- Un Médecin Infectiologue dont l’expertise permettra de discuter la durée - les relais éventuels - l’arrêt ainsi que la tolérance et l’efficacité de l’antibiothérapie choisie.
- Un Neurochirurgien qui guettera la survenue de complications mécaniques (déformation rachidienne, pseudarthrose) et/ou neurologiques, gèrera les orthèses et éventuelles les douleurs rachidiennes.
Points Forts
- Prise en charge multidisciplinaire (Neurochirurgien, Infectiologue,..)
- Complication fréquente, redoutée des patients et des chirurgiens
- Ne pas fuir , pas de rupture de communication
- Un syndrome rachidien sévère inhabituel post opératoire est un signe d’alarme
- Imageries : IRM / TDM TEP 18FDG surtout dans les infections chroniques
- Prélèvements per opératoire profond sur des sites anatomique différents ( 5).
- Traitements
- Infection précoce : prélèvements, lavage, parage (avec maintien de l’instrumentation si présente)
- Infection tardive : prélèvements, lavage, parage (avec ablation de l’instrumentation si présente)
- Associés dans les deux cas à une bi-antibiothérapie prolongée
Points Faibles
- Nombreux artéfacts à l’IRM en présence de matériel pouvant être limités par la réalisation de séquences spécifiques ou d’une TDM TEP 18FDG
- Pas de preuve des pansements aspiratifs dans la réduction ou le traitement des infections post opératoire du rachis
- L’utilisation de Vancomycine topique ne peut être préconisée en pratique courante actuellement. Nécessité d’essai clinique.
- L’émergence de bactéries résistantes en cas de traitement antibiotique empirique sans identification du ou des germes responsables.
Réponses QCMs
1) a ; c ; d
2)a ; d
3) a ; b
Littérature marquante
A. Abdul-Jabbar et al., Surgical site infection in spinal surgery : description of surgical and patient-based risk factors for postoperative infection using administrative claims data, Spine (Phila Pa 1976) 37(15) (2012) 1340-5. ➔ Article décrivant les principaux facteurs de risque chirurgicaux et liés au patient dans les infections post opératoire de la chirurgie du rachis.
SFAR. Recommandations Formalisées d’Experts : Antibioprophylaxie en chirurgie et médecine interventionnelle. (patients adultes), 2018. ➔ Guidelines actuelles sur la prévention des infections opératoires.
SPLIF : Recommandations de pratique clinique : Infections ostéo-articulaires sur matériel (prothèse, implant, ostéosynthèse), 2009. ➔ Lignes directrices dans les infections ostéo- articulaires sur matériel.
SPLIF, Recommandations pour la Pratique Clinique. Spondylodiscites infectieuses primitives, et secondaires à un geste intra-discal, sans mise en place de matériel., 2007. ➔ Lignes directrices dans la gestions des spondylodiscites infectieuses.
S.J. Kim et al., Comparing the Diagnostic Accuracies of F-18 Fluorodeoxyglucose Positron Emission Tomography and Magnetic Resonance Imaging for the Detection of Spondylodiscitis : A Meta-analysis, Spine (Phila Pa 1976) 44(7) (2019) E414-E422. ➔ Référence sur l’intérêt du TDM TEP 18FDG dans les infections du rachis notamment pour la Spondylodiscite
H.K. Li, et al and Collaborators, Oral versus Intravenous Antibiotics for Bone and Joint Infection, N Engl J Med 380(5) (2019) 425-436. ➔ Article référence démontrant la non infériorité de l’antibiothérapie per os versus IV pour les infections orthopédiques complexes notamment rachidienne.
Références annotées
- S.P. Nota, Y. Braun, D. Ring, J.H. Schwab, Incidence of surgical site infection after spine surgery : what is the impact of the definition of infection ?, Clin Orthop Relat Res 473(5) (2015) 1612-9.
- J.S. Smith, C.I. Shaffrey, C.A. Sansur, S.H. Berven, K.M. Fu, P.A. Broadstone, T.J. Choma, M.J. Goytan, H.H. Noordeen, D.R. Knapp, Jr., R.A. Hart, W.F. Donaldson, 3rd, D.W. Polly, Jr., J.H. Perra, O. Boachie-Adjei, M. Scoliosis Research Society, C. Mortality, Rates of infection after spine surgery based on 108,419 procedures : a report from the Scoliosis Research Society Morbidity and Mortality Committee, Spine (Phila Pa 1976) 36(7) (2011) 556-63.
- T. Shimizu, S. Fujibayashi, M. Takemoto, B. Otsuki, H. Kimura, M. Ota, A. Kusuba, Y. Kim, T. Soeda, K. Watanabe, T. Sakamoto, A. Uchikoshi, N. Tsubouchi, S. Matsuda, A multi- center study of reoperations within 30 days of spine surgery, Eur Spine J 25(3) (2016) 828-35.
- T. Bas, P. Bas, A. Blasco, J.L. Bas, Chronic infections of the spine, Eur J Orthop Surg Traumatol 23 Suppl 1 (2013) S35-40.
- S.L. James, A.M. Davies, Imaging of infectious spinal disorders in children and adults, Eur J Radiol 58(1) (2006) 27-40.
- S.J. Kim, K. Pak, K. Kim, J.S. Lee, Comparing the Diagnostic Accuracies of F-18 Fluorodeoxyglucose Positron Emission Tomography and Magnetic Resonance Imaging for the Detection of Spondylodiscitis : A Meta-analysis, Spine (Phila Pa 1976) 44(7) (2019) E414- E422.
- M.A. Weinstein, J.P. McCabe, F.P. Cammisa, Jr., Postoperative spinal wound infection : a review of 2,391 consecutive index procedures, J Spinal Disord 13(5) (2000) 422-6.
- S.B. Rao, G. Vasquez, J. Harrop, M. Maltenfort, N. Stein, G. Kaliyadan, F. Klibert, R. Epstein, A. Sharan, A. Vaccaro, P. Flomenberg, Risk factors for surgical site infections following spinal fusion procedures : a case-control study, Clin Infect Dis 53(7) (2011) 686-92.
- M.A. Olsen, J. Mayfield, C. Lauryssen, L.B. Polish, M. Jones, J. Vest, V.J. Fraser, Risk factors for surgical site infection in spinal surgery, J Neurosurg 98(2 Suppl) (2003) 149-55.
- A. Abdul-Jabbar, S. Takemoto, M.H. Weber, S.S. Hu, P.V. Mummaneni, V. Deviren, C.P. Ames, D. Chou, P.R. Weinstein, S. Burch, S.H. Berven, Surgical site infection in spinal surgery : description of surgical and patient-based risk factors for postoperative infection using administrative claims data, Spine (Phila Pa 1976) 37(15) (2012) 1340-5.
- M. Muschik, W. Luck, D. Schlenzka, Implant removal for late-developing infection after instrumented posterior spinal fusion for scoliosis : reinstrumentation reduces loss of correction. A retrospective analysis of 45 cases, Eur Spine J 13(7) (2004) 645-51.
- R. Haidar, A. Der Boghossian, B. Atiyeh, Duration of post-surgical antibiotics in chronic osteomyelitis : empiric or evidence-based ?, Int J Infect Dis 14(9) (2010) e752-8.
- M. Di Silvestre, G. Bakaloudis, F. Lolli, S. Giacomini, Late-developing infection following posterior fusion for adolescent idiopathic scoliosis, Eur Spine J 20 Suppl 1 (2011) S121-7.
- K. Ahsan, S. Hasan, S.I. Khan, N. Zaman, S.S. Almasri, N. Ahmed, B. Chaurasia, Conservative versus operative management of postoperative lumbar discitis, J Craniovertebr Junction Spine 11(3) (2020) 198-209.
- M. Neumaier, K.F. Braun, G. Sandmann, S. Siebenlist, C-Reactive Protein in Orthopaedic Surgery, Acta Chir Orthop Traumatol Cech 82(5) (2015) 327-31.
- SPLIF : Recommandations de pratique clinique : Infections ostéo-articulaires sur matériel (prothèse, implant, ostéosynthèse), 2009.
- SPLIF, Recommandations pour la Pratique Clinique. Spondylodiscites infectieuses primitives, et secondaires à un geste intra-discal, sans mise en place de matériel., 2007.
- P. Stradiotti, A. Curti, G. Castellazzi, A. Zerbi, Metal-related artifacts in instrumented spine. Techniques for reducing artifacts in CT and MRI : state of the art, Eur Spine J 18 Suppl 1 (2009) 102-8.
- H. Kimura, J. Shikata, S. Odate, T. Soeda, Pedicle Screw Fluid Sign : An Indication on Magnetic Resonance Imaging of a Deep Infection After Posterior Spinal Instrumentation, Clin Spine Surg 30(4) (2017) 169-175.
- F.A. Dauchy, A. Dutertre, S. Lawson-Ayayi, H. de Clermont-Gallerande, C. Fournier, P. Zanotti-Fregonara, H. Dutronc, J.M. Vital, M. Dupon, P. Fernandez, Interest of [(18)F]fluorodeoxyglucose positron emission tomography/computed tomography for the diagnosis of relapse in patients with spinal infection : a prospective study, Clin Microbiol Infect 22(5) (2016) 438-43.
- K.L. Jackson, 2nd, J.G. Devine, The Effects of Smoking and Smoking Cessation on Spine Surgery : A Systematic Review of the Literature, Global Spine J 6(7) (2016) 695-701.
- E. Mills, O. Eyawo, I. Lockhart, S. Kelly, P. Wu, J.O. Ebbert, Smoking cessation reduces postoperative complications : a systematic review and meta-analysis, Am J Med 124(2) (2011) 144-154 e8.
- Recommandations SF2H : Qualité de l’air au bloc opératoire et autres secteurs interventionnels, Mai 2015.
- SFAR. Recommandations Formalisées d’Experts : Antibioprophylaxie en chirurgie et médecine interventionnelle. (patients adultes), 2018.
- J.C. Dumville, T.A. Gray, C.J. Walter, C.A. Sharp, T. Page, R. Macefield, N. Blencowe, T.K. Milne, B.C. Reeves, J. Blazeby, Dressings for the prevention of surgical site infection, Cochrane Database Syst Rev 12 (2016) CD003091.
- R.S. Bains, M. Kardile, L.K. Mitsunaga, S. Bains, N. Singh, C. Idler, Postoperative Spine Dressing Changes Are Unnecessary, Spine Deform 5(6) (2017) 396-400.
- Impact of Enhanced Recovery After Surgery and Fast Track Surgery Pathways on Healthcare-associated Infections. Results From a Systematic Review and Meta-analysis : Erratum, Ann Surg 266(6) (2017) e123.
- B. Navalkele, J.M. Pogue, S. Karino, B. Nishan, M. Salim, S. Solanki, A. Pervaiz, N. Tashtoush, H. Shaikh, S. Koppula, J. Koons, T. Hussain, W. Perry, R. Evans, E.T. Martin, R.P. Mynatt, K.P. Murray, M.J. Rybak, K.S. Kaye, Risk of Acute Kidney Injury in Patients on Concomitant Vancomycin and Piperacillin-Tazobactam Compared to Those on Vancomycin and Cefepime, Clin Infect Dis 64(2) (2017) 116-123.
- V. Dubee, T. Lenoir, V. Leflon-Guibout, C. Briere-Bellier, P. Guigui, B. Fantin, Three- month antibiotic therapy for early-onset postoperative spinal implant infections, Clin Infect Dis 55(11) (2012) 1481-7.
- M.P. Fernandez-Gerlinger, R. Arvieu, D. Lebeaux, K. Rouis, P. Guigui, J.L. Mainardi, B. Bouyer, Successful 6-Week Antibiotic Treatment for Early Surgical-site Infections in Spinal Surgery, Clin Infect Dis 68(11) (2019) 1856-1861.
- H.K. Li, I. Rombach, R. Zambellas, A.S. Walker, M.A. McNally, B.L. Atkins, B.A. Lipsky, H.C. Hughes, D. Bose, M. Kumin, C. Scarborough, P.C. Matthews, A.J. Brent, J. Lomas, R. Gundle, M. Rogers, A. Taylor, B. Angus, I. Byren, A.R. Berendt, S. Warren, F.E. Fitzgerald, D.J.F. Mack, S. Hopkins, J. Folb, H.E. Reynolds, E. Moore, J. Marshall, N. Jenkins, C.E. Moran, A.F. Woodhouse, S. Stafford, R.A. Seaton, C. Vallance, C.J. Hemsley, K. Bisnauthsing, J.A.T. Sandoe, I. Aggarwal, S.C. Ellis, D.J. Bunn, R.K. Sutherland, G. Barlow, C. Cooper, C. Geue, N. McMeekin, A.H. Briggs, P. Sendi, E. Khatamzas, T. Wangrangsimakul, T.H.N. Wong, L.K. Barrett, A. Alvand, C.F. Old, J. Bostock, J. Paul, G. Cooke, G.E. Thwaites, P. Bejon, M. Scarborough, O.T. Collaborators, Oral versus Intravenous Antibiotics for Bone and Joint Infection, N Engl J Med 380(5) (2019) 425-436.
- A.K. Hickmann, D. Bratelj, T. Pirvu, M. Loibl, A.F. Mannion, D. O’Riordan, T. Fekete, D. Jeszenszky, N. Eberhard, M. Vogt, Y. Achermann, D. Haschtmann, Management and outcome of spinal implant-associated surgical site infections in patients with posterior instrumentation : analysis of 176 cases, Eur Spine J (2021).
- M. Jain, R.N. Sahu, A. Gantaguru, S.S. Das, S.K. Tripathy, A. Pattnaik, Postoperative Lumbar Pyogenic Spondylodiscitis : An Institutional Review, J Neurosci Rural Pract 10(3) (2019) 511-518.
- C. Barrey, O. Launay, E. Freitas, F. Michel, F. Laurent, C. Chidiac, G. Perrin, T. Ferry, The follow-up of patients with postoperative infection of the spine, Eur J Orthop Surg Traumatol 23 Suppl 1 (2013) S29-34.