#7.4 Les méningiomes intracrâniens
Julien BOETTO, M.D., CHU Montpellier, Michel KALAMARIDES, M.D., Ph.D., AP-HP, Hôpital Salle Petrière,, mars 2022.
QCM
1. Parmi les affirmations suivantes, lesquelles peuvent s’appliquer aux méningiomes :
A. L’incidence de cette pathologie augmente avec l’âge.
B. Les méningiomes sont plus fréquents chez les femmes, en particulier les formes agressives.
C. La neurofibromatose de type 2 est un syndrome de prédisposition au développement de méningiomes bénins exclusivement.
D. Un antécédent de radiothérapie cérébrale est un facteur de risque de développer des méningiomes.
E. Il y a un lien de causalité fort entre la prescription de contraception progestative microdosée et la survenue d’un méningiome.
2. Parmi les affirmations suivantes, lesquelles sont vraies pour les méningiomes :
A. Le grade histologique de la classification OMS est directement lié au pronostic en termes de survie sans récidive te de survie globale.
B. L’évolution sous la forme métastatique extra-cérébrale est exceptionnelle.
90% des méningiomes découverts de manière fortuite n’évolueront pas.
C. La présence d’une instabilité chromosomique est associée à un pronostic défavorable.
D. La présence d’une mutation du promoteur de TERT est un facteur pronostique favorable.
3. Parmi les affirmations suivantes, lesquelles sont vraies pour les méningiomes :
A. Le taux de récidive d’un méningiome de grade 1 à 5 ans est quasi nul.
B. Le traitement en première intention d’un méningiome symptomatique est l’exérèse chirurgicale.
C. La radiothérapie post-opératoire est recommandée à titre systématique en cas de résection complète d’un méningiome de grade 2.
D. Pour qu’une résection d’un méningiome soit considérée comme complète, la dure mère d’insertion doit être coagulée.
E. Le témozolomide est le traitement de référence en cas de récidive d’un méningiome malgré la chirurgie et la radiothérapie.
1. Epidémiologie et histoire naturelle
Les méningiomes (analysés histologiquement) représentent 37.6% de l’ensemble des lésions et 53.3% des lésions bénignes du Système nerveux central (SNC) (1). L’incidence des méningiomes augmente avec l’âge (18.69/100 000 après 40 ans versus 0.16/100 000 avant 20 ans). L’âge moyen au diagnostic est de 66 ans. Les études issues des travaux d’autopsie et de radiologie montrent un taux de découverte fortuit de méningiomes d’environ 2 à 3% dans la population générale (2). Les méningiomes sont plus fréquents chez les femmes, avec un sexratio de 2.33 :1 pour les méningiomes bénins, et de 1.12 :1 pour les méningiomes plus agressifs. Plusieurs facteurs de risques sont reconnus comme associés au développement des méningiomes :
- L’exposition aux radiations ionisantes : les méningiomes sont les tumeurs radio-induites du système nerveux les plus fréquentes, et le risque de développer un méningiome est de 6 à 10 fois supérieur à la population générale (3). Les méningiomes radio-induits ont la particularité d’être en général multiples, et histologiquement plus agressifs que dans la population générale, avec des taux de récidive plus élevés (4).
- Les hormones progestatives : les arguments qui supportent l’association entre les hormones sexuelles et le développement de méningiomes sont nombreux : les méningiomes sont plus fréquents chez les femmes avec un sex-ratio tout âge confondu de 2.3 :1 dont le maximum (3.15 :1) est atteint chez les femmes en âge de procréer (1) ; ils ont tendance à augmenter en volume durant la phase lutéale du cycle menstruel et durant la grossesse, et à régresser spontanément en période de post-partum (5,6) ; les méningiomes expriment des récepteurs hormonaux à la progestérone, aux estrogènes et aux androgènes dans 80%, 40% et 40 des cas respectivement (7) ; A l’heure actuelle, aucune preuve formelle ne permet d’affirmer que l’utilisation d’une contraception orale est associée à un sur risque de développer un méningiome (8). L’impact prédominent de la progestérone a été confirmé par la mise en évidence d’un sur risque significatif de développer des méningiomes lors de la prise de progestatifs de synthèse à haute dose comme l’acétate de cyprotérone, l’acétate de chlormadinone ou d’acétate de nomegestrol (9).
- Les syndromes familiaux : si la majorité des méningiomes se développent de manière sporadique, certains syndromes familiaux sont associés au développement de méningiomes (Neurofibromatose de type 2, Syndrome de Gorlin…)
Les études se focalisant sur l’histoire naturelle des méningiomes montrent que 2/3 environ des lésions vont présenter une progression radiologique. L’évolution est très généralement locale ou locorégionale. La vitesse de croissance annuelle est le meilleur facteur prédictif de la probabilité de présenter des symptômes en lien avec le méningiome(10). Le risque de métastase est excessivement faible (environ 0.1%) et concerne exclusivement les méningiomes de grade III. Les sites métastatiques les plus fréquents sont les poumons et la plèvre (60%), suivi par les sites osseux, hépatiques, ganglionnaires et rénaux(11).
2. Classification histo moléculaire
Classification histologique
La classification de l’OMS de 2016 classe les méningiomes en 15 sous-types histologiques répartis en 3 grades pronostiques sur la base de critères histologiques (Tableau 1) (12). Les grades sont corrélés à des risques de survie sans récidive et de survie globale différents, et sont à la base de la prise de décision pour les traitements à mettre en œuvre. Les méningiomes de grade I (bénins), représentent 80% des méningiomes et ont un profil d’évolutivité plutôt indolent (1,12,13). Les méningiomes de grade II (atypiques) et III (anaplasiques) représentent respectivement 17.7% et 1.7% des méningiomes, et présentent des taux de récidives beaucoup plus important ainsi traduisant un pronostic défavorable (taux de récidive à 5 ans de 50% et 75% environ, respectivement)(13). Le taux de prolifération évalué par le Ki-67 représente également un bon marqueur prédictif du risque de récidive, même s’il n’apparait pas de manière formelle dans la classification.
| Grade I | Grade II | Grade III | |
| Sous-type histologique | Méningothélial Fibroblastique Transitionnel Psammomateux Angiomateux Microkystique Sécrétoire Riche en lympho-plasmocytes Métaplasique |
Atypique A cellules claires Chordoïde |
Anaplasique Rhabdoïde Papillaire |
| Critères diagnostiques | < 4 mitoses par 10CFG | 4 à 19 mitoses par 10CFG Ou Invasion cérébrale Ou 3 des 5 éléments : Perte d’architecture/ Rapport NC élevé/ Nucléoles proéminents/ Hypercellularité/ Nécrose |
>20 mitoses par 10CFG Ou Aspect malin (carcinomateux, sarcomateux, mélanocyaire) |
| Principaux évènements génétiques associés | Mutations NF2, TRAF7, PIK3CA, KLF4, AKT1, SMO, POLR2A Perte 22q |
Mutations NF2, TRAF7, SMARCB1, SMARCE1, TERT Perte 1p, 6q, 10q, 14q, 18q Gain 1q, 9q, 12q, 15q, 17q, 20q |
Mutation NF2, TERT BAP1 Perte 9p (CDKN2AB) Amplification 17q Perte H3K27me3 |
CFG : Champs à fort grossissement ; NC : nucléocytoplasmique
Anomalies cytogénétiques
L’instabilité chromosomique est connue comme une altération moléculaire extrêmement fréquente et caractérise les méningiomes récidivants ou de mauvais pronostic (14).
L’évènement cytogénétique le plus fréquent est la perte du chromosome 22q, où est situé le gène NF2, qui concerne environ 50% des méningiomes bénins et 75 à 85% des méningiomes atypiques ou anaplasiques (15).
Mutations somatiques
Les principales mutations génétiques retrouvées dans les méningiomes sont résumées dans le tableau précédent. (16–20).
3. Présentation clinique
Les symptômes révélateurs des méningiomes sont aspécifiques, dépendent de leur topographie de développement, et sont en lien avec la compression des structures neurologiques ou vasculaires adjacentes. Les symptômes les plus fréquents amenant au diagnostic sont les céphalées (33.3-36.7%), un déficit des nerfs crâniens (28.8-31.3%), une manifestation épileptique (16.9-24%), un trouble cognitif (14.4%), un déficit neurologique (11.1%), des vertiges (9.8%), des troubles ataxiques (6.3%), des troubles sensitifs (5.6%), une exophtalmie (2%) ou une syncope (1%) (21,22). Une exostose déformante peut être présente en regard du méningiome an cas d’atteinte osseuse.
4. Bilan paraclinique
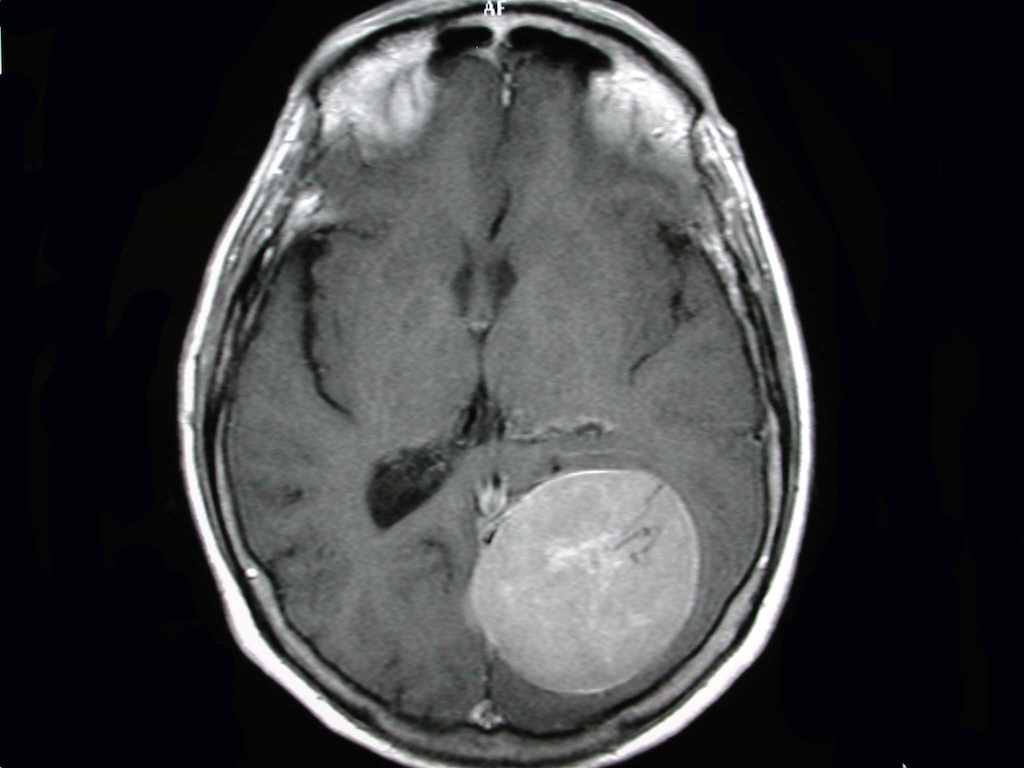
Les méningiomes sont généralement diagnostiqués grâce à un scanner ou une IRM cérébrale ou médullaire avec injection de produit de contraste. Ils se présentent généralement sous la forme d’une masse arrondie solitaire développée au dépend de la dure-mère, présentant un très fort rehaussement après injection de produit de contraste. L’aspect typique en IRM est iso-intense en séquence T1, iso ou hyper-intense en séquence T2 ou FLAIR, et rehaussé de manière intense et homogène par le Gadolinium.
Figure. IRM axial en T1 après injection de gadolinium révélait une lésion tumorale rehaussée de manière homogène, bien limitée, de topographie occipitale.
Un élargissement de la dure mère au contact du méningiome (appelé signe de la queue de comète) est présent dans 72% des cas en séquence T1 après injection de Gadolinium, mais il n’est pas spécifique des méningiomes et peut être présent dans les autres pathologies tumorales durales (23). Le scanner permet de recherche la présence de calcifications intra tumorales ou de remaniements osseux en regard du méningiome (hyperostose ou envahissement osseux tumoral).
En cas de difficulté diagnostique avec d’autres lésions méningées (métastatiques, onco-hématologiques, infectieuses ou inflammatoires), l’expression des récepteurs de la somatostatine de Type 2 (SSTR2) par les méningiomes permet l’utilisation de marqueurs comme le 68Ga-DOTATE ou le 68Ga-DOTATOC comme traceur de tomographie à émission de positrons pour corroborer le diagnostic (24).
Enfin, le bilan paraclinique sera complété par le bilan d’opérabilité et de retentissement sur les structures neurologiques (EEG, bilan ophtalmologique, bilan hypophysaire, bilan neuropsychologique…).
5. Traitement des méningiomes
Le traitement d’un méningiome est décidé au cas par cas et inclue les modalités suivantes : la surveillance radio-clinique, l’exérèse chirurgicale, la radio-chirurgie, la radiothérapie conventionnelle ou stéréotaxique, et plus rarement la chimiothérapie.
Un traitement conservateur par surveillance radio-clinique régulière est la règle pour les patients porteurs d’un méningiome de découverte fortuite et asymptomatiques. Le suivi régulier permet de s’assurer de l’absence de développement de symptômes et/ou de croissance radiologique. L’association européenne de Neuro-oncologie recommande un suivi à 6 mois, puis annuel pendant 5 ans et biannuel par la suite (25).
Le diagnostic d’un méningiome sous progestatif impose l’arrêt et la contre-indication de ce dernier. Une surveillance doit être mise en place, étant donné que la majorité des méningiomes stoppent leur croissance ou décroissent à l’arrêt des progestatifs.
Traitement chirurgical
L’exérèse chirurgicale est le traitement de choix pour les lésions symptomatiques, croissantes, ou menaçantes du point de vue neurologique. Technique de craniotomie Une exérèse chirurgicale complète permet la guérison de 70 à 80 % des patients (13). Cependant, une exérèse complète n’est pas toujours possible, en particulier pour les méningiomes situés à la base crâne et ceux envahissement les sinus veineux ou le tissu neuro-vasculaire cérébral. La qualité de l’exérèse, définie par le score de Simpson (tableau 4), doit être appréciée grâce au compte rendu chirurgical et à une IRM post opératoire d’évaluation. Grace aux progrès de l’anesthésie et de la micro neurochirurgie, le taux de résection complète ainsi que la morbidité globale de ces procédures se sont améliorés au cours du temps (26). Dans la majorité des cas, le devenir fonctionnel des patients est prioritaire sur la qualité de l’exérèse. Malgré ces progrès, l’exérèse chirurgicale est associée à une morbidité non négligeable puisque 12.3% des patients développent des déficits neurologiques nouveaux et que jusqu’à 40% des patients peuvent développer des troubles cognitifs ou émotionnels (27).
Traitement par radio-chirurgie
Un traitement par radio-chirurgie est parfois possible pour des méningiomes difficilement accessibles chirurgicalement, peu symptomatiques, et de taille modérée, ou chez des patients refusant une procédure chirurgicale.
Traitement par radiothérapie
La place de la radiothérapie après exérèse d’un méningiome de grade I est en général réservée au traitement d’une récidive (ou de la croissance d’un résidu chirurgical) non accessible à la chirurgie. Dans ce cadre-là, les modalités de la radiothérapie (radiothérapie stéréotaxique hypo-fractionnée ou radiothérapie fractionnée conventionnelle) dépendent du volume de la lésion et de sa proximité des organes à risque (13,25).
Étant donné le risque élevé de récidive des méningiomes de grade III (50 à 80% à 5 ans), la radiothérapie est systématiquement proposée en traitement adjuvant à la chirurgie, quel que soit le degré d’exérèse. Dans ce cadre-là, la radiothérapie fractionnée est généralement préférée (25).
La place de la radiothérapie dans la prise en charge des méningiomes de grade II est le domaine le plus controversé, et des variations de pratiques existent entre les différents centres. La radiothérapie diminue le risque de récidive des méningiomes de grade II opérés, et est proposée en cas de récidive tumorale ou de résection incomplète, voire de manière systématique en cas d’exérèse complète (25). Des essais randomisés sont en cours afin d’évaluer la place et le timing optimal de la radiothérapie dans ce cadre très spécifique (28).
Traitements médicaux
Dans les rares cas de méningiomes réfractaires récidivants malgré les traitements conventionnels, un traitement systémique par chimiothérapie est généralement proposé, en dépit d’un faible niveau de preuve et la faible efficacité de ces traitements (29). Les traitements les plus fréquemment administrés sont le Bevacizumab (Avastin), et l’association d’un analogue de la somatostatine (Octréotide) et d’un inhibiteur de mTOR (Everolimus) (30,31).
6. Facteurs pronostiques
Les principaux facteurs pronostiques sont :
- Cliniques : Age, état clinique défini par le score de Karnofsky
- Chirurgicaux : Degrés de résection défini par le score de SIMPSON (définis à partir des constatations peropératoires ET d’une imagerie post-opératoire, idéalement une IRM)
- Histologiques : Grade OMS
- Moléculaire : Instabilité chromosomique et mutation du promoteur de TERT
Points forts
La prise de progestatifs à haute dose doit être activement recherchée (et stoppée) devant la découverte d’un méningiome.
L’IRM cérébrale permet généralement d’affirmer le diagnostic.
L’exérèse chirurgicale est le traitement de choix pour les méningiomes symptomatiques, croissants, ou menaçants du point de vue neurologique.
Le grading selon l’OMS permet de définir la stratégie de traitement et de surveillance post-opératoire.
Points faibles
La place de la radiothérapie pour les méningiomes de grade 2 reste à définir.
Les traitements médicamenteux (chimiothérapies) des formes récurrentes ont une efficacité limitée.
Réponses QCM
1. AD
B : formes agressives plus fréquentes chez les hommes
C : les patients NF2 ont des méningiomes de tous les grades
E : Progestatifs à haute dose
2. ABD
C : 50% des méningiomes découverts de manière incidentale n’évolueront pas
E : Facteur défavorable
3. B
A : 7 à 23%
C : Non recommandée à titre systématique, sa place est débattue pour les méningiomes de grade 2
D : La dure mère doit être réséquée
Références commentées
Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas : knowledge base, treatment outcomes, and uncertainties. A RANO review. J Neurosurg. janv 2015 ;122(1):4‑23. Article de synthèse sur les méningiomes
Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. 25 oct 2019 ;1‑10. Article sur la caractérisation moléculaire des méningiomes
Goldbrunner R, Minniti G, Preusser M, Jenkinson MD, Sallabanda K, Houdart E, et al. EANO guidelines for the diagnosis and treatment of meningiomas. Lancet Oncol. sept 2016 ;17(9):e383-391. Article de synthèse de l’EANO sur le traitement des méningiomes
Références
1. Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report : Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2013-2017. Neuro Oncol. 30 2020 ;22(12 Suppl 2):iv1‑96.
2. Nakasu S, Hirano A, Shimura T, Llena JF. Incidental meningiomas in autopsy study. Surg Neurol. avr 1987 ;27(4):319‑22.
3. Wiemels J, Wrensch M, Claus EB. Epidemiology and etiology of meningioma. J Neurooncol. sept 2010 ;99(3):307‑14.
4. Umansky F, Shoshan Y, Rosenthal G, Fraifeld S, Spektor S. Radiation-induced meningioma. Neurosurg Focus. 2008 ;24(5):E7.
5. Chakravarthy V, Kaplan B, Gospodarev V, Myers H, De Los Reyes K, Achiriloaie A. Houdini Tumor : Case Report and Literature Review of Pregnancy-Associated Meningioma. World Neurosurg. juin 2018 ;114:e1261‑5.
6. Kerschbaumer J, Freyschlag CF, Stockhammer G, Taucher S, Maier H, Thomé C, et al. Hormone-dependent shrinkage of a sphenoid wing meningioma after pregnancy : case report. J Neurosurg. janv 2016 ;124(1):137‑40.
7. Portet S, Banor T, Bousquet J, Simonneau A, Flores M, Ingrand P, et al. New Insights into Expression of Hormonal Receptors by Meningiomas. World Neurosurg. août 2020 ;140:e87‑96.
8. Benson VS, Pirie K, Green J, Casabonne D, Beral V, Million Women Study Collaborators. Lifestyle factors and primary glioma and meningioma tumours in the Million Women Study cohort. Br J Cancer. 8 juill 2008 ;99(1):185‑90.
9. Weill A, Nguyen P, Labidi M, Cadier B, Passeri T, Duranteau L, et al. Use of high dose cyproterone acetate and risk of intracranial meningioma in women : cohort study. BMJ. 3 févr 2021 ;372:n37.
10. NAKASU S, NAKASU Y. Natural History of Meningiomas : Review with Meta-analyses. Neurol Med Chir (Tokyo). mars 2020 ;60(3):109‑20.
11. Kessler RA, Garzon-Muvdi T, Yang W, Weingart J, Olivi A, Huang J, et al. Metastatic Atypical and Anaplastic Meningioma : A Case Series and Review of the Literature. World Neurosurg. mai 2017 ;101:47‑56.
12. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System : a summary. Acta Neuropathol. 2016 ;131(6):803‑20.
13. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas : knowledge base, treatment outcomes, and uncertainties. A RANO review. J Neurosurg. janv 2015 ;122(1):4‑23.
14. Aizer AA, Abedalthagafi M, Bi WL, Horvath MC, Arvold ND, Al-Mefty O, et al. A prognostic cytogenetic scoring system to guide the adjuvant management of patients with atypical meningioma. Neuro Oncol. févr 2016 ;18(2):269‑74.
15. Harmancı AS, Youngblood MW, Clark VE, Coşkun S, Henegariu O, Duran D, et al. Integrated genomic analyses of de novo pathways underlying atypical meningiomas. Nat Commun [Internet]. 14 févr 2017 [cité 31 mars 2020] ;8. Disponible sur : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5316884/
16. Clark VE, Erson-Omay EZ, Serin A, Yin J, Cotney J, Ozduman K, et al. Genomic analysis of non-NF2 meningiomas reveals mutations in TRAF7, KLF4, AKT1, and SMO. Science. 1 mars 2013 ;339(6123):1077‑80.
17. Brastianos PK, Horowitz PM, Santagata S, Jones RT, McKenna A, Getz G, et al. Genomic sequencing of meningiomas identifies oncogenic SMO and AKT1 mutations. Nat Genet. mars 2013 ;45(3):285‑9.
18. Abedalthagafi M, Bi WL, Aizer AA, Merrill PH, Brewster R, Agarwalla PK, et al. Oncogenic PI3K mutations are as common as AKT1 and SMO mutations in meningioma. Neuro-oncology. 2016 ;18(5):649‑55.
19. Clark VE, Harmancı AS, Bai H, Youngblood MW, Lee TI, Baranoski JF, et al. Recurrent somatic mutations in POLR2A define a distinct subset of meningiomas. Nat Genet. 2016 ;48(10):1253‑9.
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. 25 oct 2019 ;1‑10.
21. Zouaoui S, Darlix A, Rigau V, Mathieu-Daudé H, Bauchet F, Bessaoud F, et al. Descriptive epidemiology of 13,038 newly diagnosed and histologically confirmed meningiomas in France : 2006-2010. Neurochirurgie. mars 2018 ;64(1):15‑21.
22. Magill ST, Young JS, Chae R, Aghi MK, Theodosopoulos PV, McDermott MW. Relationship between tumor location, size, and WHO grade in meningioma. Neurosurg Focus. avr 2018 ;44(4):E4.
23. Huang RY, Bi WL, Griffith B, Kaufmann TJ, la Fougère C, Schmidt NO, et al. Imaging and diagnostic advances for intracranial meningiomas. Neuro Oncol. 14 janv 2019 ;21(Suppl 1):i44‑61.
24. Galldiks N, Albert NL, Sommerauer M, Grosu AL, Ganswindt U, Law I, et al. PET imaging in patients with meningioma-report of the RANO/PET Group. Neuro Oncol. 29 nov 2017 ;19(12):1576‑87.
25. Goldbrunner R, Minniti G, Preusser M, Jenkinson MD, Sallabanda K, Houdart E, et al. EANO guidelines for the diagnosis and treatment of meningiomas. Lancet Oncol. sept 2016 ;17(9):e383-391.
26. Meling TR, Da Broi M, Scheie D, Helseth E, Smoll NR. Meningioma Surgery-Are We Making Progress ? World Neurosurg. mai 2019 ;125:e205‑13.
27. van der Vossen S, Schepers VPM, Berkelbach van der Sprenkel JW, Visser-Meily JMA, Post MWM. Cognitive and emotional problems in patients after cerebral meningioma surgery. J Rehabil Med. mai 2014 ;46(5):430‑7.
28. Jenkinson MD, Javadpour M, Haylock BJ, Young B, Gillard H, Vinten J, et al. The ROAM/EORTC-1308 trial : Radiation versus Observation following surgical resection of Atypical Meningioma : study protocol for a randomised controlled trial. Trials. 14 nov 2015 ;16:519.
29. Kaley T, Barani I, Chamberlain M, McDermott M, Panageas K, Raizer J, et al. Historical benchmarks for medical therapy trials in surgery- and radiation-refractory meningioma : a RANO review. Neuro-oncology. juin 2014 ;16(6):829‑40.
30. Graillon T, Sanson M, Campello C, Idbaih A, Peyre M, Peyrière H, et al. Everolimus and Octreotide for Patients with Recurrent Meningioma : Results from the Phase II CEVOREM Trial. Clin Cancer Res. 1 févr 2020 ;26(3):552‑7.
31. Le Van T, Graillon T, Jacob J, Vauleon E, Feuvret L, Boch A-L, et al. Multimodal management of surgery- and radiation-refractory meningiomas : an analysis of the French national tumor board meeting on meningiomas cohort. J Neurooncol. 28 mars 2021 ;