4.3.3 Traitement de la malformation artérioveineuse cérébrale.
Isabelle Pélissou-Guyotat, M.D., neurochirurgie, CHU Lyon, décembre 2020
Memento didactique
Une malformation artérioveineuse (MAV) cérébrale est constituée d’un conglomérat de vaisseaux anormaux appelé nidus au sein duquel existent un ou plusieurs shunts artérioveineux , correspondant à une communication directe entre artère et veine sans interposition de capillaire. Il s’agit donc d’un système d’échange non fonctionnel à haut flux et à faible résistance Les artères alimentant le nidus (pédicules afférents sont des artères intraparenchymateuses. Il n’y a pas de parenchyme cérébral fonctionnel au sein de la malformation (1-3).
Article : Malformation artério-veineuse cérébrale. Atos Alves de Sousa.
1. Histoire naturelle
Les MAV peuvent être diagnostiquées devant la survenue d’un épisode hémorragique en lien avec la MAV elle-même ou avec la présence d’anévrismes d’hyperdébit au sein de la malformation ou sur les pédicules artériels qui l’alimentent. La MAV est dite rompue.
La fréquence de ces ruptures qui font toute la gravité potentielle de la maladie (la mortalité d’un hémorragie sur MAV est de l’ordre de 10% et la morbidité de l’ordre de 30%) est actuellement mal connue (d’où l’intérêt de la constitution d’un registre) : le risque est apprécié de manière variable dans la littérature, évalué à 2 à 4% par an (4). Il est admis que dans l’année qui suit une rupture le risque de récidive est 2 fois plus important pour retrouver au fil du temps un risque égal à celui d’une MAV non rompue.
Une ou des crises d’épilepsie partielles ou généralisées peuvent être révélatrices d’une MAV. Le plus souvent le traitement anticomitial suffit à contrôler les crises et il est exceptionnel que les MAV soient à l’origine d’épilepsie réfractaires (5). Vidéo : MAV et épilepsie. Julien ENGELHARDT, DIU Vasculaire 2021.
Du fait des remaniements hémodynamiques il peut exister un hémodétournement par le shunt artérioveineux de la MAV qui conduit à un vol hémodynamique et être à l’origine d’un déficit par hypoperfusion des territoires adjacents : il s’agit en fait d’une situation rare. Les céphalées sont une cause fréquente de diagnostic des MAV : en dehors du cas de céphalées aigues révélatrices d’un épisode hémorragique il est presque toujours impossible de rattacher des céphalées chroniques à la MAV et l’association est considérée comme fortuite (6).
De plus en plus souvent (en lien avec l’accessibilité au scanner et IRM cérébraux) le diagnostic des MAV est fortuit. Dans ces cas comme dans tous ceux où il n’y a pas de notion d’hémorragie en rapport avec la MAV la décision d’une prise en charge thérapeutique active ou non est particulièrement difficile.
2. Exploration neuroradiologique
Quelque soit le mode de révélation symptomatique ou fortuit d’une MAV un bilan neuroradiologique complet initial doit être réalisé comprenant :
- IRM morphologique complète T1, T1GADO, T2 flair, T2* ou SWI (à la recherche de saignements passés inaperçus),3D TOF.
- Artériographie : celle-ci doit explorer tous les axes de façon sélective (carotides internes et externes, vertébrales.
Vidéo : Traitement des MAV cérébrales. Evaluation pré et post opératoire. S. Bracard, 2018.
Ce bilan est indispensable pour analyser la localisation précise de la MAV, sa taille son retentissement sur le parenchyme adjacent , l’existence éventuelle de saignements anciens ou récents, son angioarchitecture (analyse des pédicules artériels afférents, du ou des drainages veineux, présence d’anévrismes). Cela permet de classer la MAV dans les différentes classifications existantes. Vidéo : Bilan neuroradiologique pré et post thérapeutique. J.C. Gentric, DIU Vasculaire 2021
3. Méthodes thérapeutiques
Les propositions thérapeutiques sont le fruit de discussions multidisciplinaires en RCP. En dehors du traitement conservateur, le but du traitement d’une MAV est son « éradication complète » c’est-à-dire la suppression de tout shunt artérioveineux. Seule cette éradication met le patient à l’abri d’une hémorragie par rupture. Cette éradication doit être affirmée sur L’artériographie cérébrale qui reste l’examen de référence.
a) Traitement conservateur
Cette stratégie de surveillance clinique et iconographique peut être considérée comme une modalité de traitement à part entière car elle suppose une surveillance régulière de l’état clinique du patient de son IRM et des traitements adjuvants tel un traitement anticomitial. C’est une option qui est choisie au cas par cas en règle générale pour des MAV non rompues en fonction de l’appréciation de l’histoire naturelle et/ou de l’inclusion dans une étude comme TOBAS (7). Les résultats de l’étude ARUBA valide cette stratégie pour les MAV non rompues (8). Quelques particularités pédiatriques de prise en charge sont décrites Vidéo : Particularités des MAV de l’enfant. M. Vinchon, DIU Vasculaire 2021.
b) La résection microchirurgicale
C’est le traitement de référence, historiquement le premier utilisé, il est radical avec une efficacité permettant un taux d’éradication de 95% (1). Il comporte des risques immédiats (hémorragiques, déficits neurologiques en lien avec la localisation, décès). L’évaluation préalable de ces risques a conduit à l’élaboration de la classification de Spetzler-Martin, la plus utilisée aujourd’hui pour la prise en charge des MAV.
a. Technique
Le principe fondamental est le respect des veines de drainage jusqu’à l’occlusion complète des artères nourricières. Le principe est de sectionner l’ensemble des afférences artérielles du nidus de la MAV en faisant « le tour » de la malformation jusqu’à obtenir le bleuissement de la ou des veines de drainage qui permet d’affirmer qu’il n’y a plus d’alimentation des shunts artérioveineux Vidéo : Principes de la chirurgie des MAV. J-P. Lejeune, DIU Vasculaire 2021. La ou les veines de drainages qui ne sont plus dès lors sous tension sont coagulées et/ou clippées et sectionnées et le Nidus est enlevé. Un soin tout particulier doit être apporté à l’hémostase des berges du foyer d’exérèse en effet les microvaisseaux autour du nidus sont malformatifs avec une paroi particulièrement fragile et leur hémostase peut être laborieuse . Une des difficultés principales de cette chirurgie est le repérage des pédicules artériels afférents (et leur distinction d’avec les veines de drainages), ainsi que la distinction entre les vraies afférences artérielles au nidus et les artères dites « en passage » qui ne font qu‘abandonner des micropédicules au nidus pour se poursuivre vers des zones parenchymateuses fonctionnelles.
Vidéo : Traitement chirurgical des MAV cérébrales. Isabelle Pelissou-Guyotat, 2018.
La vidéoangiographie au vert d’indocyanine peut aider au repérage des différents éléments du nidus et à la confirmation de son exclusion complète en peropératoire. Vidéo : Techniques chirurgicale des MAV (non rompues) infra-tentorielles. L. Thines, 2018.
b. Efficacité
Grade I II III Taux d’éradication complète est en moyenne de 95% avec une morbi-mortalité 7,7% entrainant un mRS supérieur à 1 (4)
Grade IV V le risque de morbi-mortalité est élevé (10 à 40%) (9).
c. Complications
Les pertes sanguines plus souvent distillantes que brutales peuvent être à l’origine de complications systémiques.
les complications les plus fréquentes sont en rapport avec des déficits neurologiques liés à la localisation en zone fonctionnelle ou à la lésion d’artères « en passage »
Les complications hémorragiques post-opératoires sont plus souvent en rapport avec la persistance d’un résidu qu’avec la survenue de remaniements hémodynamiques (breakthrough syndrome)
c) Embolisation endovasculaire
Il s’agit d’obtenir l’occlusion progressive du nidus par son remplissage par des agents emboliques liquides (Glubran ou Onyx) via les afférences artérielles en prenant soin de ne pas occlure prématurément les veines de drainage (ce qui est la 1ère cause de complication hémorragique du traitement). L’évolution rapide des techniques (agents embolisateurs plus maniables , microcatheters de plus en plus fins, avec extrémités détachables , utilisation de ballons pour réduire temporairement le flux à l’intérieur de la MAV) permettent d’améliorer l’efficacité du traitement et d’en diminuer les risques Vidéo : Traitements endovasculaires. Omer EKER, DIU Vasculaire 2021. Plusieurs séances d’embolisation sont souvent programmées correspondant à l’occlusion d’un « secteur » du nidus (10).
Vidéo : Traitement des MAV cérébrales. Evaluation pré et post opératoire. S. Bracard, 2018.
Plus récemment, et dans des indications très précises une embolisation par voie veineuse rétrograde est possible. Elle suppose une oblitération complète du nidus dans une seule séance (11).
Les complications sont d’ordre hémorragiques en rapport avec une plaie vasculaire ou une occlusion veineuse prématurée, ou d’ordre ischémiques en rapport avec des complications thromboemboliques ou des occlusions d’artères en passage
Il est difficile de définir le taux d’embolisation complète car selon l’objectif du traitement (éradication ou technique adjuvante de diminution de taille et de flux préalable à une chirurgie ou à une radiochirurgie) et la sélection des patients ce taux est très variable. L’étude multicentrique BRAVO a retrouvé un taux d’occlusion complète de 23,5% avec une mortalité de 4,3% et une morbidité de 5,1% (12).
d) Radiochirurgie
a. Mécanisme d’action
La radiochirurgie stéréotaxique correspond à la délivrance en une seule fraction d’une dose élevée de rayonnement ionisant avec une forte précision Vidéo : Radiochirurgie des MAV. N. Reyns, DIU Vasculaire 2021. Différents outils et rayonnements ionisants peuvent être utilisés. La radiochirurgie détermine la mort de cellules endothéliales, la dégénérescence des fibroblastes présents dans la paroi cellulaire, et un épaississement de l’intima. Il existe une prolifération des cellules musculaires lisses qui va entrainer une occlusion vasculaire progressive (13).
b. Principes de la radiochirurgie des MAV.
La mise en place d’un cadre de stéréotaxie est en général nécessaire à la réalisation d’une radiochirurgie dans des conditions de précisions optimales. Des examens d’imagerie réalisés le jour de l’intervention (Artériographie et IRM) vont permettre de réaliser la planification du traitement. La prescription est en général effectuée pour une dose unique de 16 à 25 Gy à l’isodose de 50% mais dépendra de la technique utilisée, de la localisation et de la taille de la malformation. Plus récemment des techniques de « volume-staged radiosurgery » ont été développées. L’objectif est de pouvoir traiter des lésions de plus gros volumes dont les caractéristiques les rendent peu accessibles à la chirurgie ou l’embolisation.
c. Efficacité
L’efficacité de la radiochirurgie est donc différée Une artériographie doit être systématiquement réalisée pour confirmer une oblitération visualisée en IRM . Le délai moyen d’oblitération est de 2,5 ans (1 à 5 ans).
Il est difficile de déterminer précisément l’efficacité d’une technique car elle va dépendre du type de malformation traitée. Ding et al., dans une cohorte multicentrique de 938 MAV non rompues a montré un taux d’occlusion de 65%. Le taux de modification induite par les rayons, symptomatiques et permanente était de 9% et 3% respectivement dans cette série (14). Une revue récente de la littérature retrouve un taux d’occlusion moyen de 80% (63 à 93%) avec un taux d’hémorragie de 6% (4 à 10%) pour des MAV de grade I et II de Spetzler et Martin (15).
Les facteurs prédictifs d’une occlusion complète sont le volume de la malformation et une dose marginale élevée(12). L’impact d’une embolisation préalable à une radiochirurgie reste mal connu (16).
d. Indications
La radiochirurgie peut s’envisager comme traitement de première intention ou bien en compléments d’autres techniques, chirurgie ou embolisation, sur un résidu.
L’oblitération n’étant pas immédiate et la persistance du risque hémorragique jusqu’à son oblitération complète font choisir prioritairement ce traitement pour des MAV non rompues.
Les autres éléments entrant dans la décision sont le volume de la malformation (moins de 3cm ou moins de 12cm3), et sa localisation en zone fonctionnelle ou profonde.
e. Complications
Les complications sont de deux types :
- Le risque de saignement persiste jusqu’à l’oblitération complète de la MAVc.
Toutefois une réduction du risque de saignement est parfois reportée dans certaines études (14,5/1000 PA avant radiochirurgie pour 11,9/1000 PA après selon l’étude de Ding (17). - La survenue d’effets secondaires liés aux rayons (RIC). Ils se développent entre 6 et 18 mois après la radiochirurgie. Environ 35% des patients vont développer des modifications radiologiques induits par des rayons (hyperintensités périnidales visibles sur l’IRM), 10% des modifications symptomatiques et 4% des patients traités gardent des séquelles neurologiques. La survenue de RIC symptomatiques est plus fréquente en cas de localisation profonde. (Ilyas A et al. Neurosurgery. 2018 01 ;83(3):365–763,17,18).
- A plus long terme, certains patients vont développer des lésions kystiques parfois associés à des hématomes encapsulés. La fréquence exacte est difficile à évaluer, estimée à environ 10% à 20 ans à partir d’une série de 581 patients (18). Ceci justifie une surveillance prolongée.
4. Indications thérapeutiques
Les décisions thérapeutiques vis-à-vis des malformations artérioveineuses (MAV) cérébrales sont complexes du fait de la multiplicité des paramètres dont il faut tenir compte :
- but du traitement
- moyens thérapeutiques adaptés
- manifestations cliniques de la MAV
- âge et état général du patient
- données anatomiques et angio-architecturales de la MAV
- incertitudes concernant l’histoire naturelle des MAV
La prise en charge des MAV relève d’une prise en charge collégiale impliquant neurochirurgiens, neuroradiologues, radiochirurgiens et aussi souvent neuroréanimateurs et neurologues.
Dans tous les cas le choix du type de prise en charge dépend du patient (âge, état neurologique, comorbidités, acceptation), des caractéristiques de la MAV, mais aussi de l’expérience de l’équipe pluridisciplinaire qui prend en charge le patient.
Il faut néanmoins distinguer la prise en charge d’une MAV rompue de celle d’une MAV non rompue.
a) MAV rompue
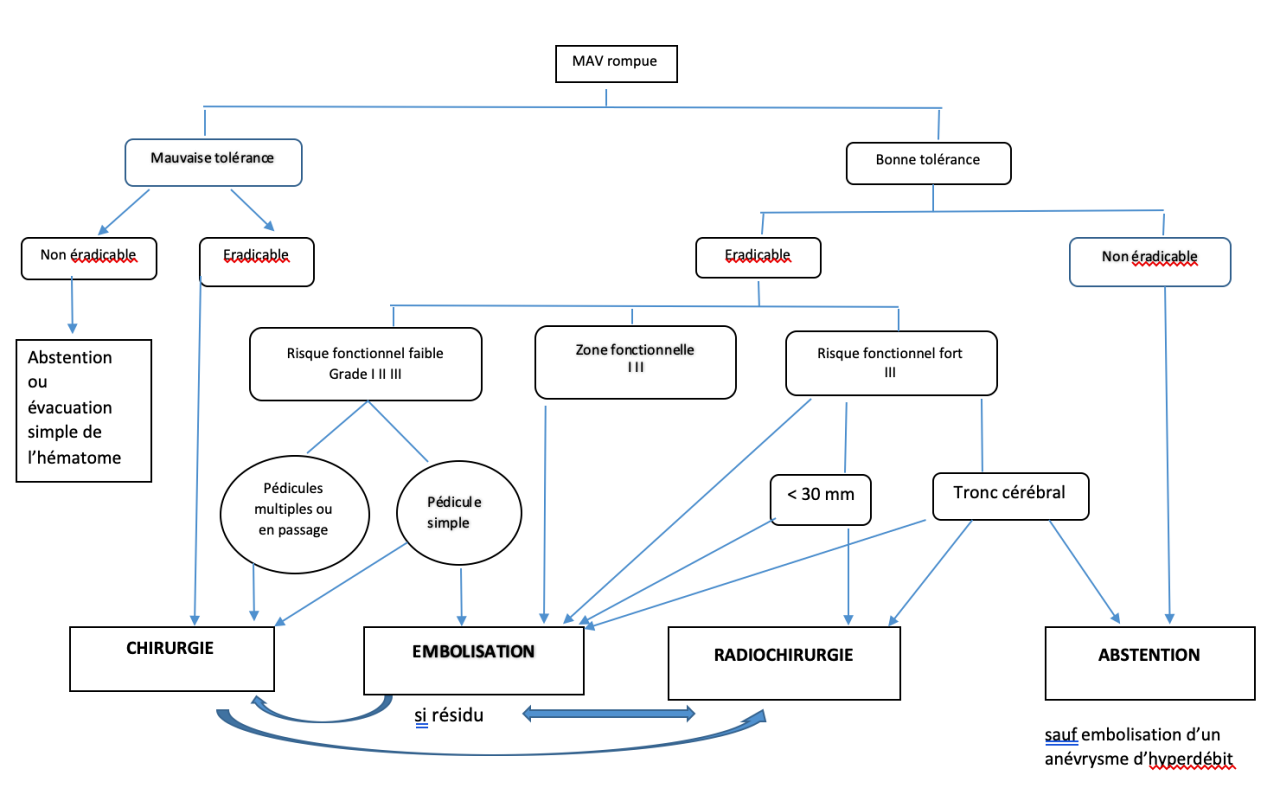
L’indication du traitement visant à éviter la récidive hémorragique est formelle 21_avenir_MAV_romopues par Th. Gaberel. Le but du traitement est donc prioritairement celui d’une éradication complète de la MAV chaque fois que cela parait faisable. (cf. Arbre décisionnel tableau 1)
Dans le cas de MAV très volumineuse qui ne parait pas accessible raisonnablement à un traitement radical des traitements « palliatifs » sont proposés (traitement endovasculaire d’anévrismes intranidaux ou d’hyperdébit, embolisation partielle en vue d’une réduction de flux) sans que l’on ait la preuve de leur efficacité en terme de réduction du risque hémorragique.
Le choix des modalités thérapeutiques est fondé sur l’analyse bénéfice/risque en privilégiant la ou les techniques dont l’efficacité sera la meilleure et la plus rapide en fonction du risque d’aggravation iatrogène (le plus souvent évalué par la classification SM ou modifiée Spetzler Ponce (19).
a. Grade I, II et III
La chirurgie est à privilégier dans ce contexte pour les malformations de grade I II ou III compte tenu de son fort taux d’exclusion complète de la MAV, immédiate en post –opératoire. L’embolisation n’est envisageable en monothérapie que pour des MAV mono ou pauci pédiculaire. Elle est souvent réalisée en pré-opératoire afin de diminuer le flux intralésionnel et de faciliter la chirurgie, en particulier par l’occlusion de pédicules profonds difficilement accessibles au début de la dissection chirurgicale.
b. Grade IV et V
Pour les Malformations de gros volume (III, IV et certains V) plusieurs séances d’embolisation peuvent permettre de réduire le volume et le flux permettant d’envisager un traitement chirurgical ultérieur et/ou éventuellement radiochirurgical.
c. Profonde
Certaines malformations profondes (par exemple noyaux gris ou tronc cérébral) de petit volume peuvent être traitées par radiochirurgie malgré le délai de l’oblitération pendant lequel persiste le risque hémorragique.
En cas de résidu le dossier nécessite à nouveau une réévaluation pluridisciplinaire.
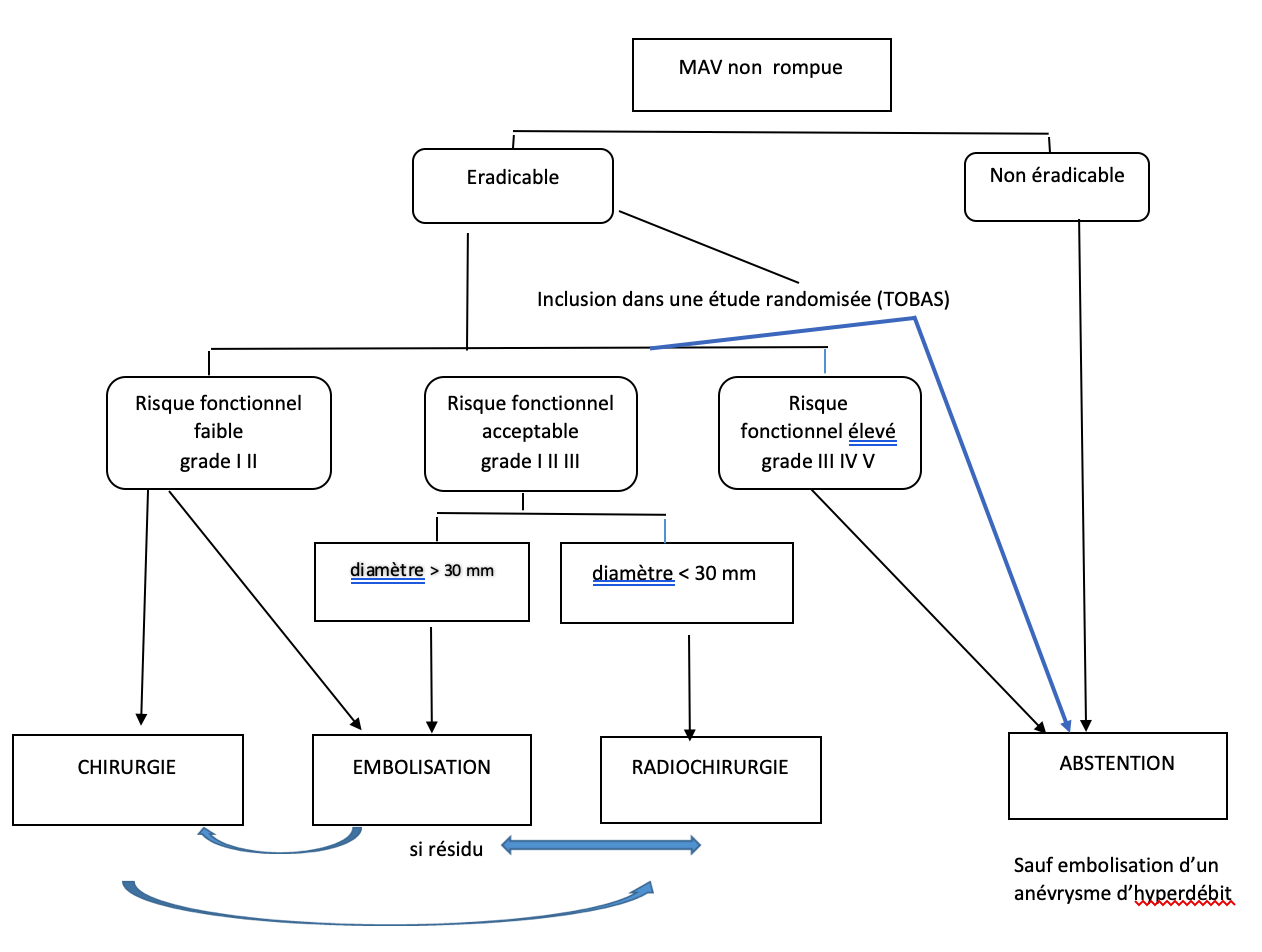
b) MAV non rompue
Dans ce cas l’incertitude concernant l’histoire naturelle des MAV prend toute sa place. L’étude multicentrique randomisée ARUBA comparant traitement conservateur et traitement actif des MAV non rompues a été interrompu prématurément 6 ans après son début en raison des résultats meilleur du traitement conservateur Vidéo : Résumé des indications thérapeutiques actuelles des MAV non rompues chez l’adulte. F. Proust, DIU Vasculaire 2021. Dans la mesure où il s’agit de la seule étude randomisée multicentrique elle a conduit à remettre en question la prise en charge invasive des MAV non rompues. Néanmoins de nombreuses critiques ont été opposées aux résultats de cette étude conduisant à la publication de guidelines (20) ou à la mise en route de nouvelles études dont l’étude TOBAS qui comprend d’une part un essai randomisé traitement vs abstention, d’autre part une étude randomisée de l’intérêt d’une embolisation préalable au traitement chirurgical ou radiochirurgical et un registre multimodal du maximum de patients porteurs de MAV traités ou non (7).
Une prise en charge thérapeutique invasive ne se justifie que si le but de l’éradication complète de la malformation peut- être raisonnablement envisagée avec un risque de morbi-mortalité acceptable ce qui doit rendre très prudent pour les MAV de grade IV et V : en effet dans ces cas de figures le taux d’éradication est souvent faible et la morbi-mortalité élevée, les effets délétères de l’histoire naturelle se cumulant à ceux des traitements. Néanmoins une aggravation transitoire ne doit pas faire méconnaître le bénéfice à long terme d’une éradication complète (nécessité d’une évaluation à un an en terme d’aggravation neurologique séquellaire par rapport à l’état pré-thérapeutique).
Dans la période actuelle « post ARUBA » il parait logique de proposer une randomisation dans l’étude TOBAS aux patients pour lesquels l’équipe pluridisciplinaire juge l’éradication de la malformation accessible avec un risque fonctionnel raisonnable
En ce qui concerne les modalités thérapeutiques les possibilités sont multiples en mono ou en multimodal, l’absence d’antécédents de rupture permettant de proposer plus largement une radiochirurgie. Quelques principes doivent être rappelés : priorité au traitement en une seule fois quand cela est possible, priorité au traitement offrant le meilleur compromis bénéfice/risque.
La réalisation d’une embolisation est à envisager en cas de MAV mono ou pauci pédiculaires sans artère en passage (l’intérêt de la voie veineuse est en cours d’évaluation dans un essai de phase II (21) ou en palliatif (traitement d’anévrismes d’hyperdébit). En préopératoire l’intérêt de l’embolisation est le même que celui exposé plus haut. En préalable à une radiochirurgie (dans l’objectif d’une diminution du volume ou du flux) il est à discuter en mettant en balance non seulement les risques inhérents à la technique mais aussi la possibilité d’une réduction de l’efficacité thérapeutique de la radiochirurgie (22).
De façon schématique lorsqu’une décision de traitement est prise (cf. Arbre décisionnel Tableau2) :
- Pour les grades I et II toutes les modalités sont utilisables en monothérapie, en cas de localisation profonde on privilégiera la radiochirurgie.
- Pour les grades III on rappelle qu’il s’agit d’un groupe très hétérogène (d’où l’existence de classification visant à l’isoler (score de Spetzler Ponce), ou le compléter (23). Le traitement est souvent multimodal.
- Pour les grades IV et V dont le traitement radical est difficile (taux d’éradication <50% et morbidité #25%) l’abstention thérapeutique est raisonnable. L’intérêt de traiter sélectivement une zone dite de fragilité est discuté.
Points forts
- Les décisions thérapeutiques vis-à-vis des malformations artérioveineuses (MAV) cérébrales sont complexes du fait de la multiplicité des paramètres.
- MAV rompue : L’indication du traitement visant à éviter la récidive hémorragique est formelle. Le but du traitement est donc prioritairement celui d’une éradication complète de la MAV chaque fois que cela parait faisable
- MAV non rompue : Tenir compte des résultats de ARUBA est important dans toute prise de décision multidisciplinaire. Une prise en charge thérapeutique invasive ne se justifie que si le but de l’éradication complète de la malformation peut- être raisonnablement envisagée avec un risque de morbi-mortalité acceptable ce qui doit rendre très prudent pour les MAV de grade IV et V
Références
1. van Beijnum J, van der Worp HB, Buis DR, Al-Shahi Salman R, Kappelle LJ, Rinkel GJ, et al. Treatment of brain arteriovenous malformations : a systematic review and meta-analysis. JAMA. 2011 ;306(18):2011-9.
2. Maruyama K, Kawahara N, Shin M, Tago M, Kishimoto J, Kurita H, et al. The risk of hemorrhage after radiosurgery for cerebral arteriovenous malformations. N Engl J Med. 2005 ;352(2):146-53.
3. Mast H, Young WL, Koennecke HC, Sciacca RR, Osipov A, Pile-Spellman J, et al. Risk of spontaneous haemorrhage after diagnosis of cerebral arteriovenous malformation. Lancet. 1997 ;350(9084):1065-8.
4. Morgan MK, Davidson AS, Assaad NNA, Stoodley MA. Critical review of brain AVM surgery, surgical results and natural history in 2017. Acta Neurochir (Wien). 2017 ;159(8):1457-78.
5. Ghossoub M, Nataf F, Merienne L, Devaux B, Turak B, Roux FX. [Characteristics of epileptic seizures associated with cerebral arteriovenous malformations]. Neurochirurgie. 2001 ;47(2-3 Pt 2):168-76.
6. Ghossoub M, Nataf F, Merienne L, Devaux B, Turak B, Roux FX. [Characteristics of headache associated with cerebral arteriovenous malformations]. Neurochirurgie. 2001 ;47(2-3 Pt 2):177-83.
7. Magro E, Gentric JC, Darsaut TE, Batista AL, Chaalala C, Roberge D, et al. [Treatment of brain AVMS (TOBAS) : A randomized controlled trial and registry]. Neurochirurgie. 2016 ;62(4):197-202.
8. Mohr JP, Parides MK, Stapf C, Moquete E, Moy CS, Overbey JR, et al. Medical management with or without interventional therapy for unruptured brain arteriovenous malformations (ARUBA) : a multicentre, non-blinded, randomised trial. Lancet. 2014 ;383(9917):614-21.
9. Laakso A, Dashti R, Juvela S, Isarakul P, Niemela M, Hernesniemi J. Risk of hemorrhage in patients with untreated Spetzler-Martin grade IV and V arteriovenous malformations : a long-term follow-up study in 63 patients. Neurosurgery. 2011 ;68(2):372-7 ; discussion 8.
10. Crowley RW, Ducruet AF, McDougall CG, Albuquerque FC. Endovascular advances for brain arteriovenous malformations. Neurosurgery. 2014 ;74 Suppl 1:S74-82.
11. Chen CJ, Norat P, Ding D, Mendes GAC, Tvrdik P, Park MS, et al. Transvenous embolization of brain arteriovenous malformations : a review of techniques, indications, and outcomes. Neurosurg Focus. 2018 ;45(1):E13.
12. Pierot L, Cognard C, Herbreteau D, Fransen H, van Rooij WJ, Boccardi E, et al. Endovascular treatment of brain arteriovenous malformations using a liquid embolic agent : results of a prospective, multicentre study (BRAVO). European radiology. 2013 ;23(10):2838-45.
13. Yang W, Porras JL, Garzon-Muvdi T, Xu R, Caplan JM, Hung AL, et al. Management Outcome of Brainstem Arteriovenous Malformations (AVMs) : The Role of Radiosurgery. World Neurosurg. 2016.
14. Ding D, Starke RM, Kano H, Lee JYK, Mathieu D, Pierce J, et al. Radiosurgery for Unruptured Brain Arteriovenous Malformations : An International Multicenter Retrospective Cohort Study. Neurosurgery. 2017 ;80(6):888-98.
15. Graffeo CS, Donegan D, Erickson D, Brown PD, Perry A, Link MJ, et al. The Impact of Insulin-Like Growth Factor Index and Biologically Effective Dose on Outcomes After Stereotactic Radiosurgery for Acromegaly : Cohort Study. Neurosurgery. 2020 ;87(3):538-46.
16. Chen CJ, Ding D, Lee CC, Kearns KN, Pomeraniec IJ, Cifarelli CP, et al. Stereotactic radiosurgery with versus without prior Onyx embolization for brain arteriovenous malformations. J Neurosurg. 2020:1-9.
17. Ding D, Chen CJ, Starke RM, Kano H, Lee JYK, Mathieu D, et al. Risk of Brain Arteriovenous Malformation Hemorrhage Before and After Stereotactic Radiosurgery. Stroke. 2019 ;50(6):1384-91.
18. Kawashima M, Hasegawa H, Shin M, Shinya Y, Ishikawa O, Koizumi S, et al. Outcomes of stereotactic radiosurgery for hemorrhagic arteriovenous malformations with or without prior resection or embolization. J Neurosurg. 2020:1-9.
19. Spetzler RF, Ponce FA. A 3-tier classification of cerebral arteriovenous malformations. Clinical article. J Neurosurg. 2011 ;114(3):842-9.
20. Cenzato M, Boccardi E, Beghi E, Vajkoczy P, Szikora I, Motti E, et al. European consensus conference on unruptured brain AVMs treatment (Supported by EANS, ESMINT, EGKS, and SINCH). Acta Neurochir (Wien). 2017 ;159(6):1059-64.
21. Fahed R, Darsaut TE, Mounayer C, Chapot R, Piotin M, Blanc R, et al. Transvenous Approach for the Treatment of cerebral Arteriovenous Malformations (TATAM) : Study protocol of a randomised controlled trial. Interv Neuroradiol. 2019 ;25(3):305-9.
22. Russell D, Peck T, Ding D, Chen CJ, Taylor DG, Starke RM, et al. Stereotactic radiosurgery alone or combined with embolization for brain arteriovenous malformations : a systematic review and meta-analysis. J Neurosurg. 2018 ;128(5):1338-48.
23. Lawton MT, Kim H, McCulloch CE, Mikhak B, Young WL. A supplementary grading scale for selecting patients with brain arteriovenous malformations for surgery. Neurosurgery. 2010 ;66(4):702-13 ; discussion 13.